Химия и химические
технологии (5)
*Бондарев Н.В., **Зайцева
И.С.
*Национальный университет им. В.Н.
Каразина, Харьков
**Харьковская национальная академия
городского хозяйства
ВЫХОД КОРОНАТОВ НАТРИЯ И КАЛИЯ (18C6MCl)
В ВОДНО-МЕТАНОЛЬНЫХ РАСТВОРИТЕЛЯХ
Рассматриваются
термодинамические основы влияния эффектов среды, равновесной концентрации
реагентов и солевых эффектов на выход продукта реакции комплексообразования
солей натрия и калия с эфиром 18-краун-6 (L) в водно-метанольных растворителях
при 298,15 К.
Для реакции образования
монокоронатов натрия и калия (MLA)
МА + L = MLA
![]()
![]()
![]() –
–![]()
![]() –
–![]()
![]()
концентрационная константа комплексообразования
(![]() ) может быть выражена через степень
превращения соли и лиганда
) может быть выражена через степень
превращения соли и лиганда
![]()
![]() ,
,
где ![]() ,
, ![]() ,
, ![]() – равновесные концентрации продукта
комплексообразования и реагентов;
– равновесные концентрации продукта
комплексообразования и реагентов; ![]() ,
,![]() =
=![]() – доли исходных реагентов (MA или L), претерпевших превращение (степень
превращения).
– доли исходных реагентов (MA или L), претерпевших превращение (степень
превращения).
Взаимосвязь
ожидаемого выхода монокоронатов (MLA) со степенью превращения реагентов имеет вид
![]() .
.
Для термодинамической константы
комплексообразования можем записать
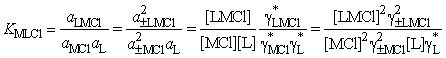 ,
,
где ![]() ,
,![]() ,
,![]() –
концентрационные коэффициенты активности лиганда и недиссоциированных молекул
электролита;
–
концентрационные коэффициенты активности лиганда и недиссоциированных молекул
электролита; ![]() ,
, ![]() –
средние ионные коэффициенты активности электролитов.
–
средние ионные коэффициенты активности электролитов.
Концентрационная
константа (![]() ) связана с термодинамической константой
устойчивости (
) связана с термодинамической константой
устойчивости (![]() ) комплексов МLCl соотношением
) комплексов МLCl соотношением
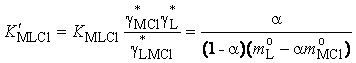 ,
,
где ![]() ,
, ![]() .
.
Откуда 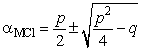 , где
, где 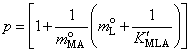 ,
, 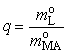 .
.
Проведено
моделирование ожидаемого выхода хлоридов коронатов натрия и калия в водно-метанольных
растворителях в интервале концентраций: 0,1 – 0,7 моль/кг растворителя для
18-краун-6 эфира и 0,1 – 2,1 m для
хлоридов натрия и калия.
Средние ионные коэффициенты
активности электролитов в водно-метанольных растворителях оценены по уравнению
Робинсона-Стокса
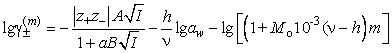 .
.
Концентрационные коэффициенты
активности краун-эфира оценены по уравнениям ![]() = 0.195mNaCl и
= 0.195mNaCl и ![]() = 0.166mKCl, принимая во внимание практически одинаковое влияние различных электролитов на коэффициенты
активности неполярных неэлектролитов типа бензола и полярных неэлектролитов.
= 0.166mKCl, принимая во внимание практически одинаковое влияние различных электролитов на коэффициенты
активности неполярных неэлектролитов типа бензола и полярных неэлектролитов.
Показано,
что оптимальному выходу коронатов соответствуют одинаковые исходные
концентрации соли и краун эфира (рис. 1). Максимальным выходам коронатов натрия
и калия отвечает условие, когда ![]() :
: ![]() ≥ 0.5 : 0.5, а содержание неводного компонента в
водно-метанольных растворителях
≥ 0.5 : 0.5, а содержание неводного компонента в
водно-метанольных растворителях ![]() мол. доли (рис. 2).
мол. доли (рис. 2).
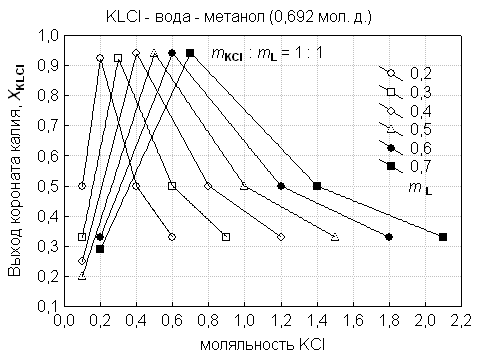
Рис 1. Зависимость выхода коронатов калия от начальной концентрации соли и краун-эфира в
водно-метанольном растворителе (0,692 мол. д. метанола).
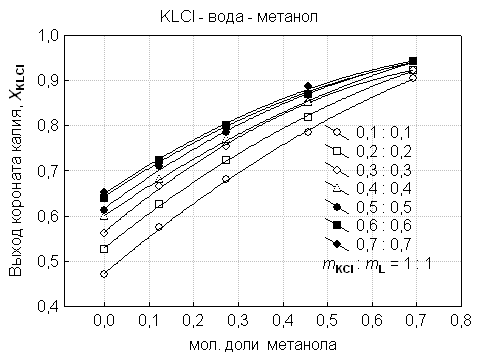
Рис 2. Зависимость выхода коронатов калия
от концентрации соли и краун-эфира (mКCl : mL = 1:1) и от
состава водно-метаноль-ного растворителя.
Показано, что увеличение выхода
коронатов в водно-метанольных растворителях по сравнению с водой зависит
преимущественно от первичных эффектов среды (энергии Гиббса пересольватации
реагентов, ![]() ):
):

ЗАЯВКА НА УЧАСТИЕ В КОНФЕРЕНЦИИ
"Европейская наука XXI века – 2007"
Украина, Днепропетровск
16-31 мая 2007год.
1. Бондарев Н.В. – к.х.н., доцент, доцент
кафедры физической химии, Харьковский национальный университет им. В.Н. Каразина,
61077, г. Харьков, пл. Свободы, 4, тел. (057)707-54-45, Е-mail: bondarev_n@rambler.ru
2. Зайцева И.С. – к.х.н., старший
преподаватель, Харьковская национальная академия городского хозяйства, 61002,
г. Харьков, ул. Маршала Бажанова, 17, тел. (057)707-31-01