Биологические науки/ Микробиология
Д. б. н. Домрачева Л.И.1, Елькина Т.С.1, Березин
Г.И.2,
Злобин С.С.2, Гайфутдинова А.Р.1
1Вятская
государственная сельскохозяйственная академия,
2Вятский
государственный гуманитарный университет, г. Киров
Использование цианобактерий для биотестирования почв
при их химическом загрязнении
Состояние микробиоты является одним из показателей,
которые в настоящее время используются для биодиагностики почвы. Среди
бактерий, постоянно присутствующих в педоценозах, особую роль играют
цианобактерии (ЦБ) как первичные продуценты органического вещества, автотрофные
по углероду (оксигенный фотосинтез) и азоту (азотфиксация у гетероцистных
форм). Вегетация этой группы организмов присуща любому типу почвы и характерна
для разных климатических зон. Наиболее явного развития ЦБ достигают при
«цветении» почвы, при котором плотность популяций ЦБ в наземных разрастаниях
достигает десятков миллионов клеток на 1 см2. Вследствие этого ЦБ
намного легче выделять в чистую культуру и идентифицировать по сравнению с
сапротрофными бактериями.
Дальнейшее биотехнологическое использование альгологически
чистых или аксеничных культур ЦБ связано как с получением на их основе
многофункциональных биопрепаратов, обладающих антагонистической, сорбционной,
детоксикационной активностью, так и с применением ЦБ в качестве
организмов-биотестеров, реагирующих на уровень загрязнения окружающей среды
поллютантами минерального и органического происхождения.
В
частности, исследования, выполненные в последние годы в Вятской государственной
сельскохозяйственной академии (Домрачева и др., 2008), показывают, что
биотестирование, проведённое с помощью ЦБ, адекватно отражает уровень
химического загрязнения среды. Метод биотестирования с использованием ЦБ
основан на определении дегидрогеназной активности этих организмов с помощью
2,3,5-трифенилтетразолий хлорида (ТТХ). ТТХ, акцептируя мобилизованный
дегидрогеназой водород, превращается в 2,3,5-трифенилформазан (ТФФ), имеющий
красную или малиновую окраску. При определении токсичности среды выбранные
штаммы ЦБ сначала выдерживаются в испытуемом растворе, затем помещаются в
раствор ТТХ, а затем микроскопическим методом определяют на мазках определяют в
популяции соотношение жизнеспособных (с красными кристаллами внутри) и нежизнеспособных
(без кристаллов) клеток.
В
частности, в ходе экспериментов при испытании на токсичность в водном
растворе солей свинца (Pb), никеля (Ni),
мышьяка (As), метилфосфоновой кислоты (МФК)
установлено, что по мере увеличения концентрации токсиканта происходит
уменьшение процентного содержания жизнеспособных клеток с одновременным ростом
процента мёртвых клеток. Например, при экспозиции культуры Nostoc paludosum в
растворах ацетата свинца возрастающей концентрации происходит стремительное
падение численности жизнеспособных клеток в популяции ЦБ с 91,47% в контроле до
4,93% при концентрации свинца 3000 мг/л (табл. 1).
Таблица 1
Влияние свинца на
жизнеспособность клеток Nostoc paludosum
(%)
|
Концентрация свинца, мг/л |
Клетки живые |
Клетки мёртвые |
|
Контроль (вода) |
91,47±1,5 |
8,53 |
|
3 |
88,20±3,16 |
11,80 |
|
30 |
18,45±4,59 |
81,55 |
|
300 |
17,07±6,74 |
82,93 |
|
1500 |
11,12±1,60 |
88,88 |
|
3000 |
4,93±0,34 |
95,07 |
Аналогичная картина наблюдается и при
действии других токсикантов на клетки ЦБ (табл. 2, 3).
Таблица 2
Влияние мышьяка на жизнеспособность
клеток Nostoc paludosum
(%)
|
Концентрация мышьяка, мг/мл) |
Клетки живые |
Клетки мёртвые |
|
Контроль (вода) |
93,93±9,30 |
6,07 |
|
10-2 |
25,48±7,31 |
74,52 |
|
10-1 |
0 |
100 |
Таблица 3
Влияние никеля на
жизнеспособность клеток Nostoc paludosum
(%)
|
Концентрация никеля, мг/мл) |
Клетки живые |
Клетки мёртвые |
|
Контроль (вода) |
96,93±4,32 |
3,07 |
|
2 |
83,53±15,40 |
16,47 |
|
20 |
2,94±2,72 |
97,06 |
Наиболее интересные и практически значимые результаты
биотестирования тетразольно-топографическим методом можно получить при работе с
почвенными вытяжками. Не отменяя и не подменяя химический анализ почв, биотестирование
даёт быстрый и чёткий ответ о состоянии почвы в исследуемом районе, особенно
если исследуемый объект является потенциально экологически опасным. Наши исследования
были проведены с образцами почвы, отобранными на территориях, прилегающей к
химическому комбинату и в зоне действия полигона захоронения ядохимикатов. Для
сравнения исследовали почвенную вытяжку серии модельных опытов, в которых в
течение 3-х месяцев изучали действие пестицидов старого и нового поколений на
почвенную микрофлору. В качестве
тест-организма использовали ЦБ Nostoc muscorum.
Так, определение жизнеспособности клеток
ЦБ в почвенной вытяжке в модельном
опыте показало, что испытуемые пестициды обладают различной степенью
токсичности по отношению к N. muscorum и
располагаются в ряд: ДДТ>Гексохлорбензол=Круйзер>Симазин=Дивиденд стар>Гербитокс=Пивот
(рис. 1). Следовательно, в группу наиболее опасных пестицидов попадают не
только старые, запрещенные к применению ДДТ и гексохлорбензол, но и пестициды
нового поколения – Круйзер и Дивиденд
стар, в то время, как гербициды Гербитокс
и Пивот оказывают на почву минимальный токсический эффект.
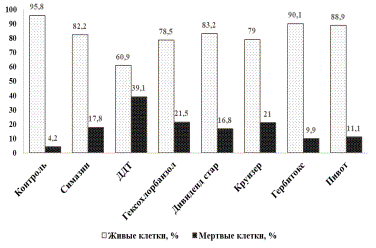
Рис. 1. Определение степени токсичности почвы после
применения пестицидов с использованием ЦБ N. muscorum
Для оценки состояния окружающей среды в районе полигона
захоронения ядохимикатов заложено 8
площадок мониторинга. При сравнении
соотношения живых и мёртвых клеток в популяции ЦБ N. muscorum
было установлено, что максимальной токсичностью обладает почва с участка №1
(более 80% нежизнеспособных клеток). Среди других участков наиболее токсичноны
площадки мониторинга №№ 3, 4, 6, где количество погибших клеток ЦБ превышает
30% (рис. 2).
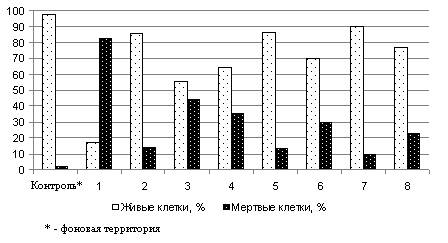
Рис. 2. Определение степени токсичности почвы в зоне
полигона захоронения пестицидов с использованием ЦБ N. muscorum
При работе в зоне действия химического
комбината мы отбирали для тестирования почвенные образцы с 8 участков. Тест-организмом
была ЦБ N. linckia. Проведение химического
анализа показало, что в данном случае загрязнителями природного комплекса являются фторид-, нитрат-ионы, катионы аммония, ионы тяжелых
металлов. При биотестировании на двух
участках отмечена 100%-ая гибель клеток ЦБ (рис. 3). Самыми чистыми можно
отменить участки 904 и 921, где гибель
клеток составляла не более 10%.
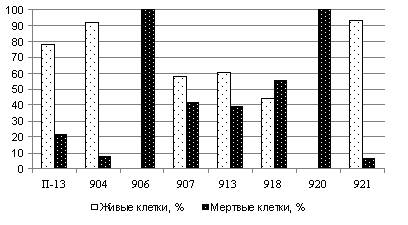
Рис. 3. Определение степени токсичности почвы в зоне
действия химического комбината с использованием ЦБ N. linckia.
Таким
образом, использование разных видов ЦБ позволяет получить оперативную
информацию о степени загрязнения почвы различными токсикантами. Данный метод
биотестирования не сложен в исполнении и определяет первоочередность
химического анализа самых загрязнённых участков для выявления конкретных
загрязнителей и их концентрации в почве.
Литература
Домрачева Л.И., Кондакова Л.В., Ашихмина Т.Я.,
Огородникова С.Ю., Олькова А.С., Фокина А.И. Применение
тетразольно-топографического метода определения дегидрогеназной активности
цианобактерий в загрязнённых средах // Теоретическая и прикладная экология,
2008. № 2. С. 23-28.