Биологические науки/ 6. Микробиология
К.б.н.
Болотникова О.И.*, Д.б.н. Михайлова Н.П.,** Д.х.н. Гинак А.И.**
Петрозаводский
государственный университет, Россия (*)
Санкт-петербургский
технологический институт
(технический
университет), Россия (**)
Стратегия использования ксилозоассимилирующих дрожжей Pachysolen tannophilus Y-1532 для получения этанола из субстратов
на основе растительной биомассы
Начало XXI века ознаменовано
необходимостью поиска возобновляемых энергоносителей, способных заменить нефть
и каменный уголь. Среди потенциальных кандидатов рассматривают солнечную
энергию, поглощаемую растениями в процессе фотосинтеза. Мощным катализатором
интереса к утилизации этого сырья стало производство биоэтанола [1]. Одним из
главных условий его конкурентноспособности на рынке моторного топлива является использование
отходов сельского хозяйства, лесопромышленного и лесоперерабатывающего
комплекса. До 62% сахаров некоторых растительных субстратов приходится на
D-ксилозу [2], традиционное сбраживание которой невозможно [3].
Ситуация в корне изменилась после
идентификации пентозо-ассимилирующих микроорганизмов [4]. Дрожжи, по сравнению
с бактериями и нитчатыми грибами, характеризуются высокой активностью
бродильного метаболизма [5], зависимостью путей распада D-ксилозы от
концентрации О2 в среде и образованием лишь одного побочного
продукта – ксилита [3]. Тем не менее, этанол в ходе катаболизма пентозы накапливают
лишь 3-и из более чем 30-ти известных видов ксилозоассимилирующих дрожжей [1,4].
Отсутствие четких биотехнологических критериев для оценки таких объектов
затрудняет промышленную конверсию растительного сырья.
Известно, что физиология микроорганизмов
определяет целый ряд технологических параметров (скорость образования целевого
продукта, глубину использования субстрата, длительность процесса и т.д.) [5]. Экспериментальные
результаты показывают, что дрожжи P. tannophilus Y-1532 (Музей микроорганизмов, ВНИИГидролиз, С.-Петербург) могут
утилизировать большинство гексозных и пентозных сахаров гемицеллюлозы (рис.1).
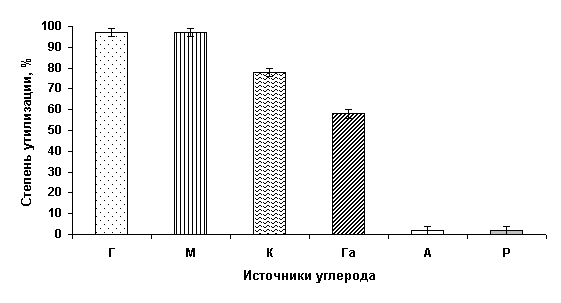
Рисунок 1. Эффективность ассимиляции гексозных и пентозных
источников углерода дрожжами P. tannophilus Y-1532
Условные
обозначения: Г - D-глюкоза; М - D-манноза; К - D-ксилоза; Га - D-галактоза;
А – L-арабиноза; Р – L-рамноза.
Их преимуществами являются незначительное время
генерации (2,79 час), относительно высокие удельная скорость роста (0,248 час-1)
и метаболический коэффициент (q=0,61 г/г•час) на среде с D-ксилозой, устойчивость к изменению температуры от 24
до 320С и рН от 3,5 до 5,0 [6]. Для культивирования пригодны
ферментационные среды с дешевыми и доступными источниками азота, серы и фосфора
(NH4)2SO4, MgSO4, KH2PO4,
K2HPO4 и дрожжевым экстрактом. Адаптация к обогащенным
танинами растительным субстратам [7], по-видимому, сформировала устойчивость P. tannophilus к токсическим примесям: рост не ингибируется в
присутствии фурфурола (0,10![]() 0,01 г/л), оксиметилфурфурола (0,27
0,01 г/л), оксиметилфурфурола (0,27![]() 0,02 г/л), летучих органических кислот (0,50
0,02 г/л), летучих органических кислот (0,50![]() 0,03 г/л), лигнофурановых веществ (1,74
0,03 г/л), лигнофурановых веществ (1,74![]() 0,20 г/л) и этанола < 3,0% об [6]. Уникальная физиологическая
пластичность делает возможным использование штамма для ферментации кислотных
гидролизатов древесины и сульфитных щелоков.
0,20 г/л) и этанола < 3,0% об [6]. Уникальная физиологическая
пластичность делает возможным использование штамма для ферментации кислотных
гидролизатов древесины и сульфитных щелоков.
Выход этанола из сложных многокомпонентных
субстратов, таких как растительная биомасса, определяет характер ассимиляции дрожжевой
клеткой гексозных и пентозных источников углерода [5]. Ферментацию модельной среды,
аналогичной гидролизату лиственной древесины, в оптимальном для накопления
спирта режиме аэрации [3] иллюстрирует рис. 2.
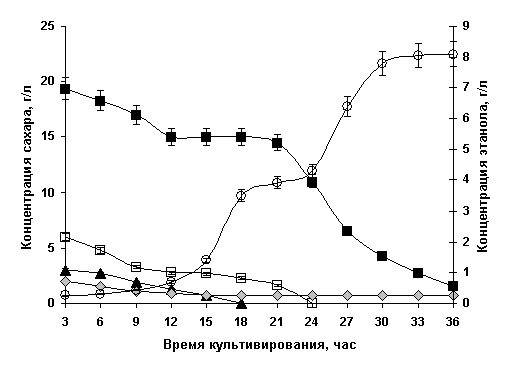
Рисунок 2. Спиртовая ферментация модельной гексозо-пентозной смеси
периодической культурой Р. tannophilus Y-1532
Условные обозначения:
|
|
-
D-ксилоза |
|
-
D-глюкоза |
|
-
D-галактоза |
|
|
-
D-манноза |
|
-
этиловый спирт |
||
Как и следовало ожидать, утилизацию большинства
сахаров P. tannophilus Y-1532 отличала диауксия. Так, 54% D-ксилозы использовалось
только при снижении концентрации D-глюкозы и D-маннозы ниже 2,0 г/л. Кинетика
продукции этанола носила двухфазный характер, соответствующий динамике потребления
различных источников углерода, свидетельствуя о целесообразности раздельной биоконверсии
гексоз и пентоз. Для этого использовали традиционный биотехнологический прием -
ферментацию сульфитного щелока (СЩ) и гидролизата лиственной древесины (ГД)
различными биокатализаторами. На первом этапе гексозы сбраживали штаммом Sacch. cerevisiae «Омские» (Музей
микроорганизмов, ВНИИГидролиз, С-Петербург) по традиционной методике [8]. Затем
P.tannophilus Y-1532 микроаэробно утилизировали
пентозы [3]. Двустадийная ферментация увеличила объемную скорость и продуктивность
этанола, а также глубину ассимиляции D-ксилозы
до 86%, что соответствовало параметрам аналогичного процесса для D-ксилозы в
качестве единственного источника углерода. Максимальная концентрация спирта
возросла с 7,40 г/л до 10,38 г/л (СЩ) и с 7,88 г/л до 22,06 г/л (ГД).
Таким образом, ферментация растительных субстратов реальна, для этого имеются все
необходимые предпосылки: культуры биокатализаторов, ассимилирующих гексозные и
пентозные сахара, дешевое сырье - отходы лесоперерабатывающего комплекса и
сельского хозяйства. Единственным отличием от стандартной технологии гидролизных
производств [8] является микроаэробный режим,
поддержание которого достижимо без существенных модификаций. Теоретический расчет показывает, что, ферментация
D-ксилозы увеличивает выход спирта на 39,4% - 96,8%, в зависимости от природы
растительного сырья.
Литература:
1. Hinman
N.D., Wright J., Hoagland W., Wayman C.E. (1989) Xylose fermentation: an
economic analysis.//Appl. Biochem. Biotechnol. 20-21: 391-401.
2. Finch
P. (1999) Carbohydrates. Structures, synthesis and dynamics. Kluwer Academic
Publishers. Dordrecht. 532р.
3.
Михайлова
Н.П., Гинак А.И., Немова Н.Н. (2010) Влияние аэрации на образование продуктов
биотрансформации D-ксилозы дрожжами Pachysolen tannophilus //Ученые записки Петрозаводского
государственного университета, Серия: естественные и технические науки. № 6(III): 14-18.
4. Mishra
P., Singh A. (1993) Microbiol pentose utilization // Adv. Appl. Microbiol. .39: 91-152.
5.
Квасников
Е.И., Щелокова И.Ф. (1991) Дрожжи: биология, пути использования. Киев: Наукова
думка, 326 с.
6.
Болотникова
О.И., Михайлова Н.П., Гинак А.И. (2011) Физиологические особенности роста
дрожжей Pachysolen tannophilus // принята в печать журналом Микология
и фитопатология.
7. Boidin
J.& Adzet J.(1957) Deux curieuses levuses isolees d’extraits tannants
d’origine vegetale: Pachysolen (nov.gen.) tannophilus nov.sp. et P.
pelliculatus nov. sp. Bulletin de la Societe Mycologique de France. 73: 331-342.
8.
Холькин
Ю.И. (1989) Технология гидролизных производств. М.: Лесная пром-сть. – 496 с.