ИЗМЕНЕНИЕ АНТИНОЦИЦЕПТИВНЫХ СВОЙСТВ ДРОПЕРИДОЛА
В УСЛОВИЯХ ГИПО- И ГИПЕРГЕПАРИНЕМИИ
Пурсанов
Кузьма Анастасович
к.м.н., доцент, НГМА, г. Н. Новгород
Перепелюк Зоя Владимировна
аспирантка ННГУ, г. Н. Новгород
E-mail
Нейролептаналгезия – своеобразный метод обезболивания, отличающийся как от наркоза, так и от местной анестезии. Нейролептаналгезия вызывается состоянием нейролепсии (действие дегидробензперидола) и выраженной аналгезии (действие фентанила).
Дегидробензперидол, или дроперидол, в наибольшей степени отвечает требованиям к идеальному нейролептику для целей анестезии по сравнению с большим числом других изученных веществ из этой группы [1]. Отличительной чертой дроперидола является низкая токсичность и большая широта терапевтической дозы [2].
Дроперидол блокирует пути, соединяющие специфическую систему проведения раздражения и ретикулярную формацию, существенно не влияя собственно на функцию ретикулярной системы. Предполагают, что восходящее проведение раздражения к ретикулярной формации подавляется, в то время как контакт ретикулярной системы сохраняется [2].
Так как гамма-аминомасляная кислота типа А и нейрональные никотиновые ацетилхолиновые рецепторы являются точкой приложения для многих анестетиков, группа авторов исследовала способность дроперидола влиять на данные рецепторы. Дроперидол ингибирует активность рецепторов: ГАМК(А)-альфа1бета1гамма2 рецептора и альфа7 никотинового ацетилхолинового рецептора. Предполагают, что субмаксимальная блокада ГАМК происходит в пределах ранга концентраций и может привести к дисфории, беспокойству, что ограничивает применение высоких доз дроперидола в клинике. Ингибирование альфа 7 никотиновых АХ рецепторов может быть ответственна за анестетическое действие дроперидола [3].
Биохимический механизм действия дроперидола связан, по-видимому, главным образом с его влиянием на моноаминовый обмен. Если придерживаться точки зрения о важном значении аминов в функции проведения в центральной нервной системе, то вызываемое нейролептиком снижение концентрации аминов в центральных синапсах должно иметь следствием нарушение нервного проведения [4,5].
Однако известно, что гепарин образует комплексные соединения с различными аминами: серотонином, норадреналином, адреналином, гистамином [6-8].
Таким образом, можно предположить, что гепарин модифицируя свойства биогенных аминов, задействованных в реализации наркотических эффектов, способен модифицировать действие лекарственных средств, в частности дроперидола, используемых для наркоза. Тем не менее, часто в анестезиологической практике используют введение наркотических средств вместе или на фоне гепарина без учета сочетанного действия их на организм [9,10].
Целью исследования явилось изучение влияния экзогенного и эндогенного гепарина на антиноцицептивные свойства дроперидола.
Эксперименты выполнены на 120 беспородных белых крысах-самцах массой 200-250 г. Ноцицептивные реакции оценивали по 2 стандартным тестам, позволяющим до определенной степени судить о характере влияния веществ преимущественно на спинальном (тест отведения хвоста – «tail flick») и супраспинальном уровнях (тест «горячей пластины» - «hot plate»). Опыты проводили на животных, прошедших фоновое тестирование, исходные ноцицептивные пороги (фон) которых в тесте I – не превышал 8 с, в тесте II – 15 с. [11].
Тест отведения хвоста основан на рефлекторной реакции отведения хвоста в ответ на нанесение болевого стимула в область верхней трети хвоста. Установка представляет собой следующее. Внутрь специального футляра (37х20х10 см) помещался источник теплового излучения (кинопроекционная лампа со встроенным отражателем типа К21-150). Питание осуществлялось от источника постоянного тока с напряжением 4,5 В при токе в 2,7 А. Встроенный отражатель лампы позволяет получить сфокусированный световой поток, диаметр светового пятна составляет 6 мм. Температура в фокусе пучка устанавливалась на значениях, вызывающих у контрольных животных четкую аверсивную реакцию отведения хвоста с латентным периодом 5-8 секунд. Фокус светового пятна совпадал с отверстием на поверхности футляра. Животное (крыса) вручную фиксировалось на операционном поле футляра и на каретке подводилось к области светового пятна. Латентный период реакции отведения хвоста (ЛП РОХ) оценивался по секундомеру.
При использовании теста «горячей пластины» животных помещали на пластину, нагретую до 57-58 0С, температура поверхности пластины регулировалась термостатом. По секундомеру засекалось время от момента помещения животного на пластину до момента первого облизывания лап (задних), что и составляло латентный период реакции облизывания лапок (ЛП РОЛ). Максимальное время нахождения животного на пластине – 25 секунд.
В работе были использованы следующие препараты, которые животным вводили внутрибрюшинно: 1) высокомолекулярный гепарин производства Московского эндокринного завода, содержащий в 1 мл раствора 5000 МЕ (1МЕ=0,0077 мг); 2) дроперидол, содержащий в 1 мл раствора 2,5 мг сухого вещества; 3) протамин сульфат, содержащий в 1 мл раствора 10 мг сухого вещества; 4) налоксон производства Варшавского фармацевтического завода Польфа, содержащий 0,4 мг/мл; 5) обзидан, производства ISIS PHARMA GmbH, содержащий 1мг/мл.
Анальгетический эффект оценивался в процентах от значений контрольной группы, принимаемой за 100%. Для оценки использовались медианы. Это связано с тем, что средняя арифметическая очень подвержена влиянию крайних членов вариационного ряда, наименее характерных для данной совокупности [12], что в случае использования нами небольших выборок (6-10 особей в группе) недопустимо. Кроме того, определённые ограничения продолжительности измерения вообще исключили в ряде опытов возможность использования какой-либо другой обобщающей характеристики. Поэтому в наших опытах использование медианы являлось наиболее оправданным.
Взаимодействие гепарина с дроперидолом in vitro изучали по изменению спектров поглощения данных веществ и их смесей в УФ области. Измерение проводили на установке, функционально идентичной однолучевому спектрофотометру. Установка включала в себя источник света (водородная лампа или лампа накаливания), монохроматор МДР-12 с шаговым двигателем, синхронный детектор, светоприемную камеру, в которой размещались кварцевые кюветы с растворами, и фотоумножитель, подключенный к ЭВМ для автоматической регистрации данных. Исследуемые вещества разводили в фосфатном буфере (рН 7,2), экстинкцию растворов измеряли относительно растворителей.
Достоверность различий между группами оценивалась непосредственно по значениям вариант с использованием непараметрического критерия Уилкоксона-Манна-Уитни для независимых совокупностей [13]. Для множественных сравнений применяли критерий Данна [14].
В первом блоке экспериментов исследовали модулирующее влияние гепарина (500 МЕ/кг) на антиноцицептивное действие дроперидола (5 мг/кг) с помощью теста реакции отведения хвоста (ЛП РОХ). Введение дроперидола приводит к постепенному увеличению латентных периодов, начиная с 60 минуты опыта, что свидетельствует о развитии анальгезии (рис. 1).
Динамика изменения ЛП РОХ при последовательном введении дроперидола и гепарина (рис.1), также как и при применении инкубированной смеси дроперидола и гепарина (1:5) носит периодический характер. Связанный с дроперидолом гепарин, также как и гепарин, введенный через 10 минут после дроперидола, оказывает незначительное влияние на уменьшение антиноцицептивного действия дроперидола. В комплексе гепарин задерживал развитие дроперидолвызванной анальгезии. Наиболее выраженный эффект отмены действия дроперидола наблюдали при предварительном (за 10 минут) введении гепарина. Межгрупповой статистический анализ показал достоверное различие (р<0,05) между группами «дроперидол» и «гепарин, дроперидол» на 120 минуте. Через сутки действие нейролептика выявлено не было.
Таким образом, степень воздействия экзогенного гепарина на развитие анальгезии, вызванной дроперидолом можно представить в виде схемы: «гепарин до» > «связанный гепарин» > «гепарин после».
Влияние гепарина на антиноцицептивное действие дроперидола, оказываемое на спинальном уровне, носит временной характер и зависит от последовательности введения.
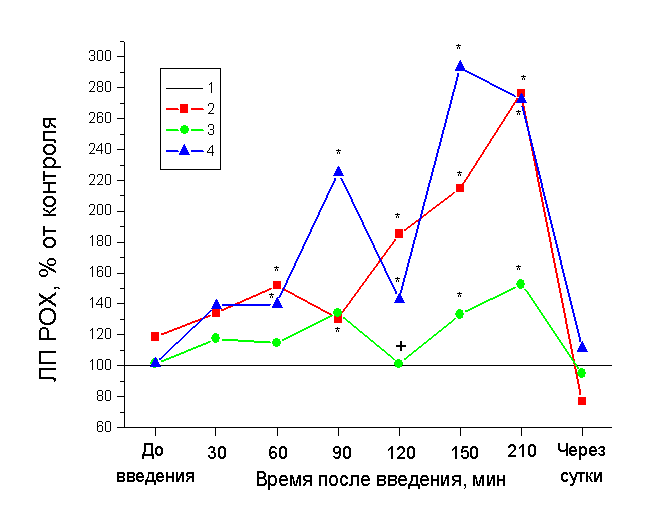
Рис. 1. Влияние дроперидола и гепарина на реакцию отведения
хвоста у крыс
1 – контроль,
2 – дроперидол (5 мг/кг),
3 – гепарин (500 МЕ/кг) перед дроперидолом (5 мг/кг),
4 – дроперидол (5 мг/кг) перед гепарином (500 МЕ/кг).
* – p < 0.05 по сравнению с контролем,
+ – p < 0.05 по сравнению с дроперидолом
Динамика изменений длительности латентных периодов при введении дроперидола на фоне протамин сульфата (10 мг/кг), являющегося классическим антагонистом гепарина, указывает на незначительную роль эндогенного гепарина в модуляции эффекта дроперидола при оценке болевой чувствительности с помощью теста реакции отведения хвоста.
Изменение тонуса различных нейрохимических систем, принимающих участие в обезболивании, можно вызвать с помощью модуляции активности их рецепторных механизмов. Данный подход получил довольно широкое распространение в экспериментальных и клинических исследованиях. В связи с этим представляет особый интерес рассмотрение результатов экспериментов с участием фармакологических соединений, изменяющих активность рецепторов, а именно, с применением неселективного блокатора опиоидных рецепторов – налоксона, так как, общепринято, что эндогенной опиоидной системе отводится лидирующая роль в контроле боли, а также неселективного блокатора β-адренергических рецепторов – обзидана (пропранолола), так как данные рецепторы принимают непосредственное участие в реализации большинства адаптивных реакций, в том числе, предполагается, и в регуляции болевой чувствительности при различных видах воздействий [15].
Как выяснилось в наших опытах, в реализации анальгетического эффекта дроперидола принимает участие эндогенная опиоидная система. При предварительном введении налоксона (1 мг/кг) достоверно (р<0,05) подавлялось антиноцицептивное действие дроперидола, введенного без гепарина, длительность латентных периодов реакции отведения хвоста в данной группе и контрольной практически не отличалась. В то же время, налоксон не оказывал влияния на анальгезию, вызванную дроперидолом при любом сочетании с гепарином. Значения ЛП РОХ в группах «налоксон, дроперидол, гепарин» и «налоксон, гепарин, дроперидол» были на 100 - 150% достоверно выше (р<0,05) контрольных и исходных величин, начиная с 60 минуты и в течение последующих 150 мин эксперимента. Статистически значимые различия между группой без применения гепарина и группами, в которых на фоне налоксона дроперидол вводился вместе с мукополисахаридом в разных вариантах, были зарегистрированы на 60, 90, 120 и 210 минуте опыта. Таким образом, при блокировании опиоидных рецепторов гепарин либо оказывает влияние на опиоидные рецепторы, либо способствует проявлению анальгетической активности дроперидола через иные механизмы.
Одними из наиболее важных в регуляции многих функций организма являются β-адренергические рецепторы. Вклад данной системы в антиноцицептивные процессы, происходящие на спинальном уровне при применении дроперидола и гепарина, оценивали с помощью использования блокатора β-адренергических рецепторов обзидана, вводимого внутрибрюшинно в дозе 1 мг/кг. Торможение активности β-адренергических рецепторов вызывает частичное подавление противоболевого действия дроперидола, достоверное отличие от контроля (р<0,05) получили только на 120 и 150 мин опыта (рис. 2).
Следует отметить, что динамика изменений латентных периодов РОХ при введении обзидана после дроперидола и гепарина мало отличалась от таковой в опыте с дроперидолом и гепарином (рис.1), анальгетическая активность была достоверно снижена на 90 и 120 мин опыта. Предварительное применение обзидана до введения дроперидола и гепарина (3-я группа) дало неожиданную реакцию нарушения двигательной функции задних конечностей у животных, которая не наблюдалась в других группах и продолжалась в течение 1,5 часов и отразилась на длительности латентных периодов, т.е., наиболее выраженный нейролептический эффект дроперидола при сочетании с гепарином получили при предварительной блокаде β-адренергической системы. Возможно, именно влияние гепарина на β-адренергическую систему играет ключевую роль в подавлении антиноцицептивной активности дроперидола при предварительном введении мукополисахарида (рис. 2).
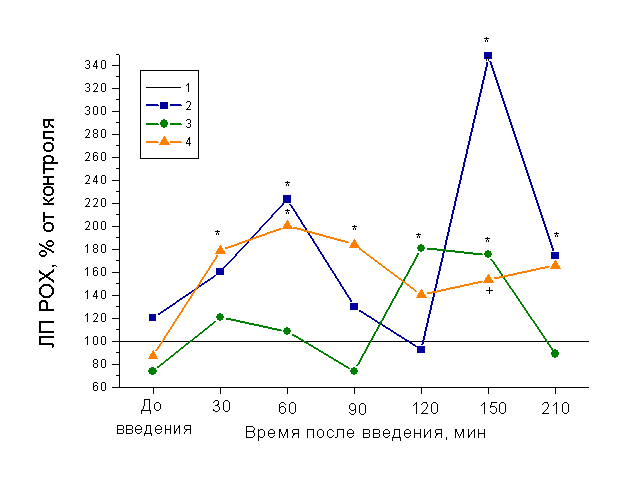
Рис. 2. Влияние дроперидола, гепарина и обзидана на реакцию
отведения хвоста у крыс
1 – контроль;
2 – дроперидол (5 мг/кг) перед гепарином (500 МЕ/кг), обзидан (1 мг/кг);
3 – обзидан (1 мг/кг), дроперидол (5 мг/кг);
4 – обзидан (1 мг/кг), гепарин (500 МЕ/кг) перед дроперидолом (5 мг/кг).
* – p < 0.05 по сравнению с контролем,
+ – p < 0.05 по сравнению с группой «гепарин, дроперидол, обзидан».
В следующем блоке экспериментов при анализе влияния тех же веществ (дроперидола, гепарина, налоксона, обзидана, протамин сульфата) был применен другой способ тестирования – болевую чувствительность оценивали по латентным периодам реакции облизывания лап (ЛП РОЛ). При этом из всего набора применяемых нами сочетаний препаратов статистически значимых межгрупповых различий установлено не было, а увеличение длительности ЛП РОЛ произошло на 30 мин только в группе при введении дроперидола на фоне антагониста гепарина – протамин сульфата (рис. 3).
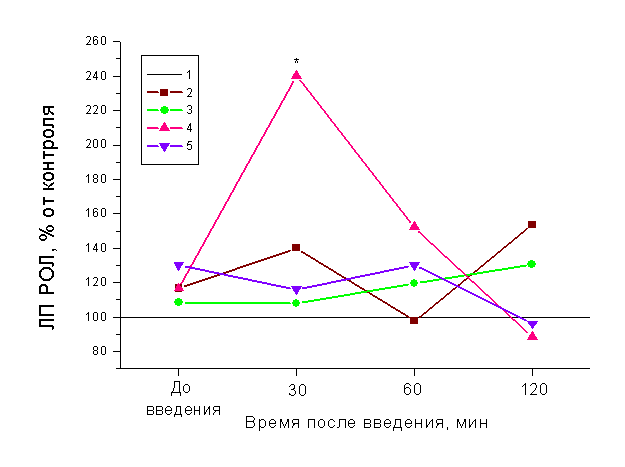
Рис. 3. Влияние дроперидола, гепарина, протамин сульфата и налоксона
на реакцию облизывания лап у крыс
1 – контроль;
2 – дроперидол (5 мг/кг);
3 – дроперидол + гепарин (1 : 5);
4 – протамин сульфат (10 мг/кг), дроперидол (5 мг/кг);
5 – налоксон (1 мг/кг), дроперидол (5 мг/кг).
* – p < 0.05 по сравнению с контролем.
Вероятнее всего данный прирост был вызван стресс-реакцией на введение фармакологических агентов, на это указывает также пикообразный характер динамики изменений ЛП РОЛ с последующим резким сокращением. Возможно, эндогенный гепарин выполняет в организме отчасти стресслимитирующую функцию, и блокада центральных дофаминовых путей дроперидолом на фоне гипогепаринемии, вызванной протамин сульфатом, только усиливает эту стресс-реакцию на болевой термический стимул, на участие дофаминовых механизмов указывает и повышение болевой чувствительности по сравнению с исходным уровнем на 35% в группе с дроперидолом на 60 мин. С этой точки зрения, можно рассматривать стабилизирующие эффекты гепарина и налоксона в сочетании с дроперидолом, в данных группах значения ЛП РОЛ были близки к контрольным и исходным.
Отличие результатов полученных разными способами анальгезиометрии указывает на различия в характере воздействия дроперидола и гепарина, оказываемое на спинальном и супраспинальном уровнях.
При исследовании взаимодействия гепарина с различными веществами для доказательства комплексообразования in vitro в числе прочих физико-химических методов широко применяют анализ спектров поглощения веществ в УФ-области [16,17], поскольку изменения спектров исходных веществ в составе смеси свидетельствуют о модификации их химической структуры, возможном образовании химических связей, конформационных изменений молекул и т. п. (рис. 4).
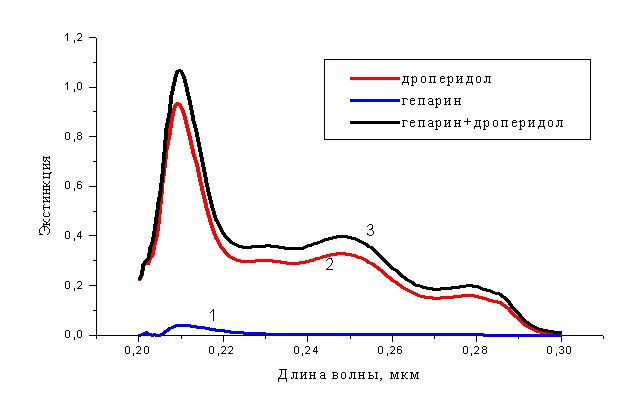
Рис. 4. Спектры поглощения дроперидола
(0,01 мг/мл), гепарина (5,0 МЕ/мл) и их смеси в УФ области (200 – 300 нм)
1. Гепарин; 2. Дроперидол; 3. Гепарин + дроперидол.
Дроперидол, разведенный в фосфатном буфере (рН 7,2), концентрация 0,01 мг/мл, имеет характерный спектр поглощения в УФ- области с выраженными максимумами при длине волн 210, 250 и 280 нм и слабым пиком при 230 нм. Гепарин в фосфатном буфере, в концентрации 5 МЕ/мл, имеет слабо выраженный пик поглощения при 210 нм, а в области 230 - 300 нм экстинкция раствора практически равна 0. Спектр поглощения смеси дроперидола с гепарином в тех же концентрациях характеризуется увеличением экстинкции раствора примерно на 15 - 20% практически по всей области длин волн (200 300 нм). Очевидно, что изменения спектра дроперидола при добавлении гепарина только отчасти объясняются суммированием светопоглощающих свойств входящих в смесь компонентов, и то лишь в диапазоне 200 - 220 нм (рис. 4). По-видимому, такое увеличение экстинкции свидетельствует об изменении химической структуры компонентов смеси, а именно, о возможности комплексообразования между дроперидолом и гепарином. Увеличение экстинкции во всем диапазоне длин волн свидетельствует, скорее всего, об увеличении молекулярных частиц в растворе, то есть о возникновении химических связей различной природы между молекулами гепарина и дроперидола.
Таким образом, экзогенный и эндогенный гепарин, в зависимости от вариантов сочетанного применения с дроперидолом, оказывает на анальгетическое действие нейролептика разнонаправленное действие. Исследования, проведённые in vitro, показывают, что антиноцицептивное действие дроперидола может блокироваться за счёт взаимодействия с гепарином, с образованием комплексных соединений. Кроме того, возможно, влияние гепарина на β-адренергическую систему, которая играет ключевую роль в подавлении антиноцицептивной активности дроперидола при предварительном введении мукополисахарида. При блокировании опиоидных рецепторов гепарин либо оказывает влияние на опиоидные рецепторы, либо способствует проявлению анальгетической активности дроперидола через иные механизмы.
Литература
1. Военнов О.В., Бояринов Г.А. Комбинированная нейролептанальгезия при
острой ишемической болезни сердца. Общая реаниматология 2006; 2 (2): 12-18
2. Bergmann H. Die Neuroleptanalgesie. Wien. Klin. Wscher. 1964; 76: 969
-974.
3. Flood P., Coates K.M. Droperidol inhibits GABA(A) and neuronal nicotinic receptor activation. Anesthesiology 2002; 96 (4): 987 – 993.
4. Дарбинян Т.М. Нейролептаналгезия. М.: Медицина, 1973.
5. Беляков В.А. К вопросу об анальгетической активности дроперидола. В кн.: Клинические и теоретические аспекты острой и хронической боли. Тезисы Российской научно-практической конф. Н.Новгород; 2003. 35-36.
6. Gandhi N.S., Mancera R.L. Free energy calculations of glycosaminoglycan-protein interactions. Glycobiology 2009; 19 (10):
1103-1115.
7. Liang A., Liu X., Du Y., Wang K., Lin B. Further characterization of the binding of heparin to granulocyte colony-stimulating factor: Importance of sulfate groups. Electrophoresis 2008; 149 (2): 109-112.
8. Хомутов А.Е., Пурсанов К.А. Биологические и клинические основы апитерапии. Н. Новгород: Изд-во НГМА, 2011.
9. Бакарева Ю.А., Надирадзе З.З., Доманский А.В. Влияние методики анестезии на течение послеоперационного периода у детей, оперированных с искусственным кровообращением. Общая реаниматология 2009; 5 (2): 86-89.
10. Бабаев М.А., Ерёменко А.А., Винницкий Л.И., Бунятян К.А. Причины возникновения полиорганной недостаточности при кардиохирургических операциях в условиях искусственного кровообращения. Общая реаниматология 2010; 6 (3): 48-52.
11. Гацура В. В. Методы первичного фармакологического исследования БАВ. М: Медицина, 1974.
12. Ашмарин, И. П Быстрые методы статистической обработки и планирования экспериментов. Л.: Наука, 1975.
13. Гублер Е.В., Генкин А.А. Применение непараметрических критериев статистики в медико-биологических исследованиях. Л: Наука,1973.
14. Гланц Стентон. Медико-биологическая
статистика. М.: Практика, 1999.
15. Брагин, Е. О. Нейрохимические механизмы регуляции болевой чувствительности. М.: Изд-во УДН, 1991.
16. Кудряшов Б.А., Ляпина Л.А. Комплекс гепарин - аспирин; его
физико-химические и физиологические свойства.
Вопр. мед. химии 1977; 23 (1): 44 – 51.
17. Ляпина Л.А., Пасторова В.Е., Кудряшов Б.А. Комплексные соединения гепарина и их физиологическое значение. Успехи физиол. наук 1989; 20 (1): 90 – 105.