Биологические науки / 9.
Биохимия и биофизика
К.б.н. Холявка М.Г., д.б.н. Ковалева Т.А.,
д.б.н. Артюхов В.Г., Гречкина М.В., Останкова И.В.
ФГБОУ ВПО Воронежский государственный
университет, Россия
Молекулярная и надмолекулярная
организация инулиназ
Изучение структурных особенностей и
функциональных свойств инулиназ (КФ 3.2.1.7) имеет теоретическое и прикладное
значение. Эти ферменты участвуют в углеводном метаболизме высших растений и
микроорганизмов, являются важнейшими компонентами сигнальных путей, играют одну
из ключевых ролей в контролировании процессов клеточной дифференцировки и
развития. Они также могут быть использованы в циклах производства сахаров с
различной степенью полимеризации, в частности, фруктозы и инулоолигосахаридов –
неотъемлемых компонентов функционального питания, снижающих риск возникновения
сахарного диабета, кариеса и ожирения.
Цель нашей
работы заключалась в изучении структурной организации инулиназ различного
происхождения. Объектами исследования
были гомогенные препараты инулиназы из Kluyveromyces marxianus и Aspergillus niger, а
также три фракции, выделенные из Helianthus
tuberosus, обладающие
инулиназной активностью, которые мы условно назвали инулиназа I, инулиназа II и инулиназа III. Схемы и протоколы очистки
ферментов представлены в работе [1].
Путем сочетания атомно-силовой
микроскопии (АСМ) с методами динамического светорассеяния, гель-хроматографии и
электрофореза были определены размеры и молекулярные массы инулиназ различного
происхождения (табл.). Наши результаты согласуются с данными литературы: размер молекулы инулиназы из Aspergillus awamori составляет 64.726×82.041×136.075 Å [2].
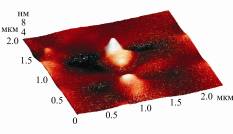
На объемном изображении поверхности молекулы инулиназы из Kluyveromyces marxianus, полученном с помощью АСМ, отчетливо видно, что
данный белок имеет димерную
структуру (рис.). Длина нативной глобулы намного превышает ее высоту, возможно,
что такое уплощение молекулы происходит за счет многоточечного связывания
заряженных аминокислотных остатков с поверхностью слюды. Методом АСМ
показано, что инулиназа из Aspergillus niger также является гетеродимером.
Продемонстрировано, что инулиназа I
из Helianthus
tuberosus (рис.) образует димеры (причем на
изображении встречаются в равной степени как димеры, так и мономеры), а
инулиназы II и III существуют в мономерной форме.
Таблица. Размеры (нм) и молекулярные массы (кДа)
инулиназ
|
Продуцент |
Нативная молекула |
Субъединицы |
|||||||
|
R, нм* |
нм** |
кДа |
R, нм* |
нм** |
кДа |
R, нм* |
нм** |
кДа |
|
|
Kluyveromyces marxianus |
6.1 |
9.2 |
63 |
5.2 |
4.2 |
55 |
1.0 |
2.9 |
8 |
|
Aspergillus |
12.6 |
6.4 |
102 |
5.1 |
3.4 |
62 |
1.7 |
2.2 |
37 |
|
Helianthus
tuberosus инулиназа I |
5.5 |
6.7 |
65 |
3.2 |
3.4 |
46 |
1.0 |
1.8 |
22 |
|
инулиназа II |
1.0 |
3.1 |
31 |
|
|||||
|
инулиназа III |
1.1 |
1.8 |
25 |
||||||
|
* радиусы
молекул, определенные методом динамического светорассеяния на приборе Photocor complex; ** высоты молекул,
определенные методом атомно-силовой микроскопии (АСМ) на приборе SOLVER P47PRO. |
|||||||||
Для понимания механизма действия инулиназ in vivo необходимо
исследовать их структурно-функциональные свойства, особенности молекулярной и
надмолекулярной организации. В литературе имеются противоречивые данные
относительно структурных особенностей инулиназ. Это характерно не только для
ферментов, полученных из различных видов одного рода (в качестве примера могут
послужить роды Kluyveromyces, Aspergillus и Arthrobacter), но даже для энзимов, выделенных из штаммов
одного и того же вида микроорганизма. Одни авторы утверждают, что инулиназа
представлена только в мономерной форме, другие показывают наличие четвертичной
структуры в виде димера или даже тетрамера [3-12].
|
|
|
|
|
|
|
Д |
|
Рисунок.
Визуализация молекул инулиназ из различных продуцентов методом атомно-силовой
микроскопии: А – инулиназа из Kluyveromyces marxianus, Б – инулиназа из Aspergillus niger, В – инулиназа I
из Helianthus tuberosus, Г – инулиназа II из Helianthus tuberosus, Д – инулиназа III из Helianthus tuberosus.
Из проведенного анализа работ
можно сделать вывод о том, что исследования пространственных особенностей
инулиназ необходимо расширять и развивать, так как вопрос о существовании
надмолекулярной организации у этой группы энзимов до сих пор окончательно не
решен. Неизвестно, почему у одних организмов фермент функционирует в качестве
мономера, а у других как димер или даже тетрамер.
Литература:
1.
Холявка М.Г.
Исследование структурно-функциональных свойств гомогенных и гетерогенных
биокатализаторов на основе инулиназы : Дис. канд. биол. наук. Воронеж: ВГУ,
2010. 178 с.
2.
Arand M., Golubev A.M., Neto J.R., Polikarpov I.,
Wattiez R., Korneeva O.S., Eneyskaya E.V., Kulminskaya A.A., Shabalin K.A.,
Shishliannikov S.M., Chepurnaya O.V., Neustroev K.N. // Biochem. J. 2002. V.
362. № 1. P. 131–135.
3.
Kushi R.T., Monti R., Contiero J. // J. Indust.
Microbiol. Biotechnol. 2000. V. 25. P. 63–69.
4.
Rouwenhorst R.J., Hensing M., Verbakel J., Scheffers
W.A., Dijken J.P. // Appl. Envirion.
Microbiol. 1990. V. 56. № 11. P. 3337–3345.
5.
Uhm T.B., Chung M.S., Lee S.H., Gourronc F.,
Housen I., Kim J.H., Van Beeumen J., Haye B.,
Vandenhaute J. // Biosci. Biotechnol. Biochem. 1999. V. 63. № 1. P. 146–151.
6.
Gill P.K., Manhas R.K., Singh J., Singh P. // Appl. Biochem. and Biotechnol. 2004. V. 117. № 1. P. 19–32.
7.
Uhm T.B., Jeon D.Y., Byun S.M., Hong J.S.,
Grootwassink J.W. // Biochim.
Biophys. Acta. 1987. V. 926. P. 119–126.
8.
Ji Y., Zhao X. // Wei Sheng Wu
Xue Bao. 1998. V. 38. № 2. P. 120–125.
9.
Yokota A.,
Enomoto K., Tomita F. // J. Ferment. Bioeng. 1991. V. 72. № 4.
P. 262–265.
10.
Haraguchi K., Kishimoto M.,
Seki K., Hayashi K., Kobayashi S., Kainuma K. // Agric. Biol.
Chem. 1998. V. 52. P. 291–292.
11.
Kawamura M., Takahashi S.,
Uchiyama T. // Agric. Biol. Chem. 1988. V.
52. P. 3209–3210.
12.
Uchiyama T., Niwa S., Tanaka K. // Biochim. Biophys. Acta. 1973. V.
315. P. 412–420.
 А
А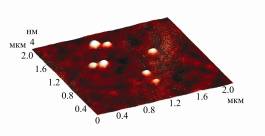 Б
Б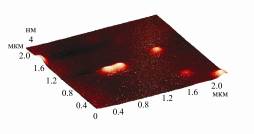 В
В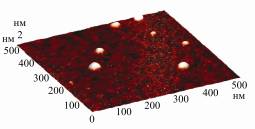 Г
Г