Ковалева Т.А., Макарова
Е.Л.
Воронежский государственный университет, Воронеж
Исследование термостабильности
глюкоамилазы иммобилизованной на
коллагене
В последние годы
особое внимание уделяют амилазам, широко распространенным в природе,
физико-химические свойства которых были изучены на ранних стадиях развития
энзимологии [1]. Повышенный интерес к амилазам как эффективным биокатализаторам
обусловлен их применением в медицине, тонком органическом синтезе, пищевой и
легкой промышленности.
Глюкоамилаза (α-1,4:1,6
глюкан-4,6-глюкогидролаза, КФ 3.2.1.3) катализирует реакцию гидролиза крахмала
до глюкозы, атакуя только внешние нередуцирующие концы цепей полисахаридов, и
широко используется в разработке новых прогрессивных технологий.
Ферменты
относительно лабильные полипептидные соединения природного происхождения, их
промышленное применение затруднено из-за неустойчивости при хранении и
температурных воздействиях.
Иммобилизация приводит
к повышению стабильности по отношению к денатурирующим факторам внешней среды
по сравнению со свободными ферментами. Поэтому
нами была проведена сорбционная иммобилизация глюкоамилазы (α-1,4:1,6
глюкан-4,6-глюкогидролаза, КФ 3.2.1.3) на коллагене, выделенном из
соединительной ткани крупного рогатого скота.
Объектом исследования
послужил фермент глюкоамилаза из Аspergillus awamori, препарат Г20Х
производства Ладыжинского завода ферментных препаратов, подвергнутый
специальным методом очистки.
Для определения
активности глюкоамилазы использовали глюкозооксидазный метод. Принцип метода
заключается в том, что глюкоза окисляется кислородом воздуха при каталитическом
действии глюкозооксидазы с образованием перекиси водорода и глюконата.
Возникшую перекись водорода определяли по реакции окислительного азосочетания с
замещенным фенолом и 4-аминоантипирином, которая катализируется пероксидазой.
Расчет каталитической
активности производили по формуле:
![]() ,
,
где а - количество
глюкозы, образовавшейся в 1 мл гидролизата, мкг;
b- количество фермента в 1 мл гидролизата,
мг/мл;
t- время гидролиза, мин;
180- молекулярная
масса глюкозы.
В качестве субстрата
использовали растворимый картофельный
крахмал фирмы «Экрос».
Для
сорбционной иммобилизации фермента использовали коллаген, выделенный
ферментативным методом из соединительной ткани крупного рогатого скота на
кафедре технологии мяса и мясопродуктов
Воронежской государственной технологической академии
[2].
Для осуществления сорбционной иммобилизации 5 г коллагена
оставляли на ночь при комнатной температуре в 25,6 мл ацетатного буфера (рН
4,5). 5 мл раствора фермента (10-5 моль/л) добавляли к суспензии
носителя и перемешивали в колбе с помощью электрической мешалки в течение 1,5
часа при температуре 25°С. Центрифугировали при 3000 об/мин 5 мин, осадок промывали ацетатным буфером
(рН 4,5), затем дистиллированной водой до отсутствия в промывных водах белка
(контроль осуществляли на СФ-26 при l=280
нм). Содержание белка в иммобилизованном ферменте определяли модифицированным
методом Лоури, а каталитическую активность –глюкозооксидазным методом, причем
инкубацию иммобилизованного фермента с субстратом осуществляли при
перемешивании с помощью магнитной мешалки в течении 30 минут [3].
Была
осуществлена сорбционная иммобилизация глюкоамилазы на коллагене. Показано, что
для иммобилизованного фермента характерен более широкий диапазон температур, при которых она проявляет
максимальную каталитическую активность по сравнению со свободным ферментом (45-60
0С) с максимумом при 55 0С.
При этом нативный фермент имеет оптимальную способность к гидролизу крахмала
при 50 0С. Следовательно, глюкоамилаза, иммобилизованная на
коллагене, более стабильна к воздействию высоких температур (Риc.1).
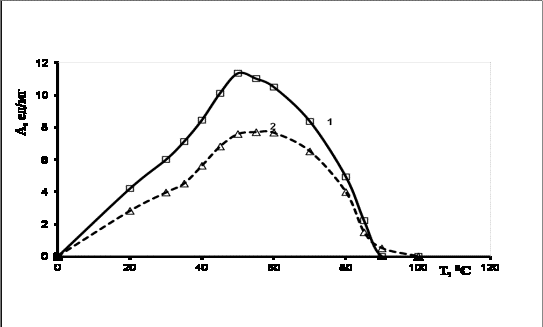
Рис.1 Зависимость каталитической
активности свободной и иммобилизованной глюкоамилазы из Aspergillus awamori от температуры
Анализ
результатов экспериментов показывает, что глюкоамилаза характеризуется высокой
термоустойчивостью и при нагревании до 80 0С проявляет значительную каталитическую активность
(43,3%), при адсорбционной иммобилизации на коллагене процент сохранения
каталитической активности достоверно увеличивается (51,6%). Причем полная
инактивация свободного фермента наступает при 90 0С. Показано, что для иммобилизованной глюкоамилазы
наблюдается сдвиг на 5 0С в сторону более высоких температур.
Характеристикой процесса
инактивации является константа скорости инактивации (k, ч-1),
представляющая собой потерю каталитической активности, приходящуюся на единицу
активности фермента при нагревании в течение часа.
k=2,3lg25Ео, где
Еo – исходная активность,
принятая за 100 %;
Е – активность фермента в
момент времени ῖ, % от исходной.
Таблица 1
Константы скорости
термической инактивации глюкоамилазы, иммобилизованной на коллагене
|
Фермент |
T, °С |
K, ч-1 |
|
Свободная глюкоамилаза |
50 |
0,32 |
|
60 |
0,37 |
|
|
70 |
5,77 |
|
|
Иммобилизованная глюкоамилаза |
50 |
0,28 |
|
60 |
0,28 |
|
|
70 |
3,96 |
Установлено, что константы скорости инактивации
для иммобилизованной глюкоамилазы при данных температурах 50 °С, 60 °С, 70 °C значительно ниже, чем
для свободного фермента.
Мы
проанализировали не только абсолютные значения каталитической активности
свободной и иммобилизованной глюкоамилазы. Но и процент сохранения способности
к гидролизу крахмала в диапозоне температур 50 – 70 °С в течение 50 минут. Обнаружено, что при иммобилизации
энзима на коллагене имеет место достоверное увеличение термостабильности. Так
при температуре 50 °С иммобилизованный
ферментный препарат сохраняет каталитическую способность к гидролизу субстрата
на 86,4%, при 60 °С- на 84,9%, при 70 °С- 1,5%. После 50-минутного нагревания образцы нативного
энзима сохраняли 84%, 79%, 0% первоначальной каталитической способности
соответственно.
Таким
образом, процесс термической инактивации глюкоамилазы при иммобилизации на
коллагене замедляется и оптимальная температура гидролиза субстрата сдвигается
вправо на 5 °С, что может быть
обусловлено участием в процессе адсорбции различных участков молекулы
глюкоамилазы и поэтому могут происходить различные конформационные перестройки в третичной
структуре фермента, ответственной за каталитическую способность.
Литература:
1.
Жеребцов
Н.А. Амилолитические ферменты в пищевой промышленности / Н.А. Жеребцов. – М. :
Легкая и пищевая промышленность, 1984. – С.-160 .
2. Антипова
Л.В., Глотова И.А.: Использование вторичного коллагенсодержащего сырья мясной
промышленности / Л.В. Антипова, И.А.Глотова. – СПб : ГИОРД, 2006. – 165-245с.
3. Кочетов
Г.А. Практическое руководство по энзимологии. – М.:Высш. шк., 1980. – 272 с.