Химия и химические технологии
/ 2. Кинетика и катализ
К.х.н. Мальцева В.С., аспирант Сазонова А.В.
Юго-Западный государственный университет, Курск, Россия
Кинетика сорбции тяжелых металлов на
природных модифицированных минералах
К числу наиболее опасных веществ, загрязняющих
биосферу и способных кумулироваться в ней, относятся ионы тяжелых металлов.
Наибольший вклад в отравление окружающей среды тяжелыми металлами вносят
предприятия горнодобывающей и перерабатывающей промышленности,
горно-обогатительные предприятия, а также гальванические производства. Они
характеризуются большим объёмом сточных вод и высоким содержанием ионов тяжёлых
металлов (до 50-200 мг/л), что во много раз превышает ПДК [1].
Актуальность задачи сорбции ионов тяжёлых металлов с
целью их удаления из объектов окружающей среды обусловлена чрезвычайно широким
их распространением в различных технологических процессах. Сорбционный метод
очистки сточных вод является достаточно высокоэффективным и перспективным.
Современный уровень состояния физической химии
характеризуется достаточно глубоким изучением однокомпонентных адсорбентов
(активированный уголь, силикагели, оксиды металлов, кремнезём и др.) [2].
Следующим этапом развития в данном направлении – исследование закономерностей
сорбции ионов тяжелых металлов в сложных многокомпонентных системах. Для этой
цели эффективно применение природных минералов.
Из-за большого разнообразия
карбонатных пород Курской области представляло интерес использовать их в
качестве сорбента. С этой целью были опробованы карбонатные породы Конышовского
района.
Сопоставление
экспериментальных и литературных данных показывают, что породы Конышовского района относятся к мелоподобным
мергелям (CaCO3 – от
45,95 до 49,5 %; Аl2O3 и Fe2O3 –
от 1,53 до 1,84%; SiO2 – от 9,85 до 11,2%). Данная порода
представлена мельчайшими скелетами организмов и микрозернистым кальцитом, тонко
перемежающихся с глинистыми частицами и имеет характерный светло серый цвет.
Для повышения сорбционной способности природных минералов используют
модифицирование их поверхности. Самыми простыми и распространенными способами
модификации является термическая и химическая обработка. Модификация
проводилась химическим способом (обработкой 20% раствором серной кислоты) и
термическим (прокаливанием при 800ºС до постоянной массы сорбента в
течении 2 часов) [3].
При
изучении сорбционных характеристик сорбента по отношению к ионам меди (II) и хрома (III) необходимо
определить время, в течение которого в системе устанавливается равновесие.
Изучение кинетики сорбции осуществляли в статических условиях методом
ограниченного объёма раствора. Остаточную концентрацию ионов меди (II) определяли в виде аммиаката спектрофотометрическим
методом по стандартной методике, а суммарное содержание малых количеств хрома (III) и (VI) проводили
фотометрическим методом в присутствии дифенилкарбазида.
Степень сорбции (S, %) показывает долю абсолютного количества вещества,
которое улавливается сорбентом и дает достаточно полное представление о
характере процесса [4]. Данный показатель является важным критерием при исследовании
кинетики процесса сорбции:
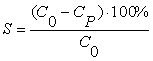 , (1)
, (1)
где С0 – исходная концентрация,
г/л; СР – равновесная
концентрация, г/л.
За окончательный результат
принято среднее арифметическое трех повторных
измерений.
Оптимальные
соотношения фаз сорбции ионов тяжелых металлов на природных модифицированных
минералах, при которых изучали кинетику процесса, представлены в таблице 1.
Таблица
1 – Оптимальные соотношения фаз сорбции тяжёлых металлов на природных карбонатных
породах
|
Система Параметр |
Медь(II) |
Хром (III) |
|||
|
Прокалённый сорбент |
Обработанный кислотой сорбент |
Прокалённый сорбент |
Обработанный кислотой сорбент |
||
|
Время сорбции, мин |
5 |
10 |
20 |
10 |
|
|
Масса, г |
0,5 |
0,1 |
|||
|
Размер частиц, мм |
0,06 - 2,0 |
||||
|
Объём, мл |
20 |
||||
|
Исходная концентрация,
мг/л |
1000 |
20 |
|||
Известно,
что исследование кинетики сорбции позволяет получить большую информацию о
процессе в целом (скорость достижения равновесия, коэффициент диффузии, емкость
сорбента, лимитирующая стадия процесса сорбции). Поэтому знание кинетических
закономерностей необходимо для установления оптимальных параметров сорбции
различных загрязнителей.
При
сравнении кинетики процесса очистки от ионов тяжелых металлов прокаленным и
химически модифицированным сорбентом использовали оптимальные соотношение фаз,
указанные в таблице 1. Зависимость степени сорбции (S, %) от времени сорбции ионов меди (II) и хрома (III) модифицированными
карбонатными минералами представлена в таблице 2.
Таблица
2 – Зависимость степени сорбции (S, %) от времени
сорбции ионов меди (II) и хрома (III) модифицированными
карбонатными минералами
|
Время сорбции, мин |
Медь (II) |
Хром (III) |
||
|
Прокалённый сорбент |
Обработанный кислотой сорбент |
Прокалённый сорбент |
Обработанный кислотой сорбент |
|
|
1 |
98,5 |
90 |
98,2 |
98,5 |
|
2,5 |
99,75 |
98,5 |
98,3 |
98,7 |
|
5 |
100 |
99,5 |
98,5 |
98,9 |
|
10 |
100 |
100 |
98,9 |
100 |
|
15 |
100 |
100 |
99,25 |
100 |
|
20 |
100 |
100 |
100 |
100 |
При
изучении процесса очистки сточных вод от ионов меди (II) и хрома (III) установлено,
что основной эффект извлечения ионов достигается в первые минуты после начала
контакта сорбентов и модельных растворов. Полное извлечение ионов меди (II) обработанным кислотой сорбентом достигается за 10
минут, прокаленным сорбентом - за 5 минут. Полная
сорбция ионов хрома (III) обработанным кислотой сорбентом наблюдается за 10 минут, прокаленным – за 20 минут. После наступление
100%-ной сорбции дальнейшее увеличение времени контакта фаз нецелесообразно.
Увеличение
сорбционной способности модифицированных сорбентов можно объяснить тем, что в
процессе обработки происходит образование активных центров. Использование
термической модификации для данного вида сорбента представляется наиболее эффективным
для сорбции ионов, что можно объяснить появлением мезапористой структуры у
термически обработанного карбоната. В них образуются свободные оксиды кальция и
магния, что также улучшает сорбционную способность исследуемого минерала [4].
При этом адсорбция в водных растворах происходит преимущественно на поверхностных
кислородосодержащих активных центрах (ПАЦ), присутствующих на поверхности
сорбента, за счет водородных связей при относительно слабых дисперсионных
взаимодействиях молекул воды с поверхностью
карбонатного сорбента. Далее, при увеличении концентрации рост адсорбции
замедляется, что связано с заполнением ПАЦ. Адсорбированные молекулы воды
становятся, в свою очередь, вторичными адсорбционными центрами, на которых за
счет водородных связей адсорбируются другие молекулы воды с образованием
двумерных комплексов.
Эффективное
использование сорбента в процессе извлечения тяжёлых металлов в некоторой
степени определяется скоростью сорбции. Сорбционная емкость и константы сорбции
модифицированных карбонатных пород по отношению к ионам меди (II) и хрома (III) представлены в таблице 3.
Таблица
3 - Сорбционная емкость и константы сорбции модифицированных карбонатных пород
по отношению к ионам меди (II) и хрома (III)
|
Система Параметр |
Медь (II) |
Хром (III) |
||
|
Прокалённый сорбент |
Обработанный кислотой сорбент |
Прокалённый сорбент |
Обработанный кислотой сорбент |
|
|
Константа сорбции, ∙ммоль/(л∙мин) |
3,125 |
1,563 |
0,019 |
0,038 |
|
Сорбционную ёмкость, мг/г |
40 |
4 |
||
Согласно
полученным данным о кинетике сорбции, сорбционной емкости и константах сорбции для
очистки вод от ионов меди (II)
рекомендуется использование прокаленного сорбента (К=3,125
ммоль/(л∙мин). Для удаления ионов хрома (III) наиболее эффективным является химическая модификация
сорбента (К=0,038 ммоль/(л∙мин).
Однако для данных видов модификации
неотъемлемым условием протекания благоприятного процесса сорбции являются
правильные условия хранения карбонатного минерала. При длительном хранении
модифицированных сорбентов на открытом воздухе в них увеличивается содержание
влаги, что крайне неблагоприятно сказывается на процессе сорбции ИТМ.
Полученные экспериментальные данные исследований показали достаточно высокую
адсорбционную способность природной карбонатной породы по отношению к ионам
тяжелых металлов.
Литература:
1. Зубарев, Г.И. , Гуринович А.В. Глубокая
очистка сточных вод гальванического производства // Экология и промышленность России, декабрь 2008. – С. 16.
2. Кирейчева Л.В., Андреева Н.П.
Комплексные сорбенты для очистки сточных вод от органических соединений и ионов
тяжёлых металлов // Водоочистка, водоподготовка, водоснабжение, №1, 2009. С.
43-46.
3. Сазонова А.В., Ниязи Ф.Ф., Мальцева
В.С. Термодинамика и кинетика сорбции ионов хрома (III) карбонатными
породами // «Современные
проблемы науки и образования», г. Москва, 2012, №1. http://www.science-education.ru/101-5305.
4. Фролов Ю.Г. Курс коллоидной химии.
Поверхностные явления и дисперсные системы. Учеб. для вузов. М.: Химия, 1988,
464 с.