к.б.н. Бактыбаева Л.К., Мырзалиева Д.,
Абдрахманова Ж.
НИИ
«Проблем биологии и биотехнологии» при Казахском национальном университете
имени аль-Фараби, Алматы, Казахстан
ИЗМЕНЕНИЕ УРОВНЯ ТОКСИЧНОСТИ
ИССЛЕДУЕМЫХ СОЕДИНЕНИЙ РЯДА БИВ В
УСЛОВИЯХ ОСТРОЙ ИНТОКСИКАЦИИ ОРГАНИЗМА ЖИВОТНЫХ СОЛЯМИ ТЯЖЕЛЫХ МЕТАЛЛОВ
Безусловно,
доклинические испытания химических соединений на фармакологическую активность
должны начинаться с оценки безопасности. Любое химическое вещество, в том числе
и лекарственное средство, при поступлении в организм является неспецифическим
раздражителем, т.е. стрессорным фактором для всего организма. При изучении
острой токсичности (однократное введение препарата) регистрируются токсикодинамические
и токсикокинетические данные и определяется среднелетальная доза данного
соединения (ЛД50). Но следует учитывать факт, что показатель ЛД50
изменяется в зависимости от состояния организма. На организм оказывают влияние
абиотические и биотические факторы среды, в том числе и химические соединения
окружающей среды. Среди химических веществ, загрязняющих различные объекты
внешней среды, металлы образуют значительную группу токсикантов. Учитывая все
возрастающие масштабы производства и применения металлсодержащих ксенобиотиков,
их высокую токсичность, способность накапливаться в организме человека,
оказывать вредное влияние даже в сравнительно низких концентрациях, данные
химические загрязнители отнесены к числу приоритетных [1, 2]. Целью наших исследований
было проследить изменение уровня токсичности новых соединений и препарата
сравнения в условиях отравленного соединениями свинца, цинка и кадмия организма.
Материалы и методы
Материалом
служили белые беспородные мыши
обоего пола двух- и трехмесячного возраста массой 17-26 г, 130 особей. Исследования
проводили в соответствии с «Правилами проведения работ с использованием
лабораторных животных». Для определения токсического воздействия солей тяжелых металлов лабораторных животных
разделили на 12 экспериментальных групп по 20 особей и 1 контрольную по 10
особей. Острое отравление мышей проводили водой с содержанием солей тяжелых
металлов с 50-кратным превышением предельно допустимой концентрации (ПДК) для солей
тяжелых металлов в питьевой воде. При 50 - кратном превышении ПДК: 1 - ой
группе животных вводили воду с солью сульфата цинка (Zn2+) в
концентрации 250 мг/л (119 мг/кг), 2 – ой группе - воду с солью ацетата свинца
(Pb2+) в концентрации 1, 5 мг/л (0, 714 мг/кг), 3 – ой группе - воду с солью хлорида кадмия
(Cd2+) в концентрации 0, 05 мг/л (0, 02 мг/кг), 4 группе - воду с
солями хлорида кадмия (Cd2+) + ацетата свинца (Pb2+) + сульфата
цинка (Zn2+) в концентрации 0, 05 + 1,5 + 250 мг/л. Контрольная
группа получала обычную питьевую чистую воду. Животным вводили растворенные в
воде соли перорально в объеме 1 мл/сут., в течение 10 дней. Острую токсичность (ЛД50) новых соединений определяли внутрибрюшинным
введением белым лабораторным мышам обоего пола, Контроль за состоянием
животных проводили визуально (по состоянию покровов, активности и т.д.). Острая
токсичность новых соединений сопоставлялась с данными препарата левамизола.
Статистическую обработку результатов проводили с помощью программы Microsoft Excell.
РЕЗУЛЬТАТЫ.
Проведенные исследования острой
токсичности новых синтетических соединений на интактных животных показал
следующие результаты. В целом все соединения исследуемого ряда проявили очень
низкий показатель острой токсичности. Уровень острой токсичности соединений БИВ
– 4 и БИВ – 6 был ниже в 21, 2 раза, чем у препарата сравнения левамизола (p
≤0, 01). Значения ЛД50 соединений БИВ-4, БИВ-6 были более 1000
мг/кг, тогда как уровень токсичности препарата сравнения превышал их показатели
в 21, 2 раза, составляя 47, 24±0,71 мг/кг (p ≤0, 01). Токсичность трех
соединений БИВ-1, БИВ-2, БИВ-7 также была очень низкой, находясь в диапазоне от
787, 045±8,38 до 851,138±1,38 мг/кг, что при сопоставлении в 17,1 раз (p
≤0, 01) уступало уровню токсичности левамизола. Лишь соединения БИВ – 3 и
БИВ – 5 показали ЛД50 в
диапазоне от 396,278±3,28 до 446,68±3,24 мг/кг, однако и они были менее
токсичны при сопоставлении с препаратом сравнения в 8, 4 раза (p ≤0, 01)
(рис.1, ряд 1).
Таблица 1 - Острая токсичность
соединений
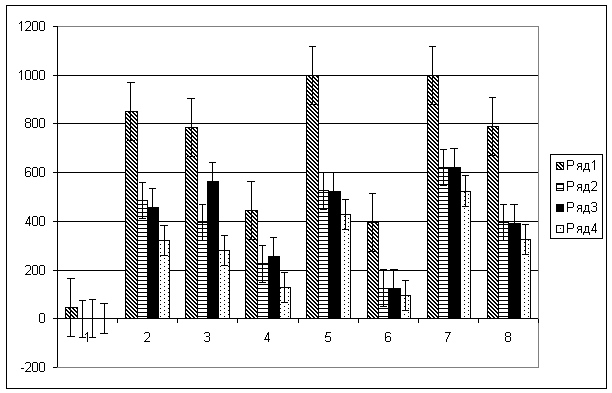
Рисунок 1
– Острая токсичность соединений
ряда БИВ при различных видах интоксикации
1 – препарат левамизол, 2 – соединение БИВ-1,
3 – соединение БИВ-2, 4 – соединение БИВ-3, 5 – соединение БИВ-4, 6 –
соединение БИВ-5, 7 – соединение БИВ-6, 8 – соединение БИВ-7.
Ряд 1 – уровень острой токсичности соединений,
полученный на интактных животных, ряд 2 – уровень острой токсичности соединений
на фоне острой интоксикации организма животных ацетатом свинца, ряд 3 – уровень
острой токсичности соединений на фоне острой интоксикации организма животных
сульфатом цинка, ряд 4 – уровень острой токсичности соединений на фоне острой
интоксикации организма хлоридом кадмия.
Следующая серия опытов по
определению острой токсичности соединений была проведена на животных, с
избирательной формой интоксикации: либо солью цинка, либо ацетатом свинца, либо
хлоридом кадмия. Интоксикацию в первой группе животных проводили ацетатом
свинца. На фоне острой интоксикации солью свинца уровень острой токсичности
всех исследуемых соединений вырос, особенно у препарата сравнения левамизола.
Не было найдено дозы введения, при которой он не проявлял бы летального
действия. Уровень токсичности у соединений ряда БИВ вырос в 1, 61 – 3, 14 раза.
Более, чем в 3, 14 раза вырос уровень острой токсичности у соединения БИВ – 5 с
396,278±3,28 мг / кг до 126,96±1,28 мг/кг (p ≤0, 05). У других соединений
летальная доза выросла в 1, 61 – 2,00 раза (рис.1, ряд 2).
Во второй группе животных, с острой формой интоксикации сульфатом цинка
была получена аналогичная картина изменения уровня острой токсичности соединений. Максимально высокий уровень регистрировался
у левамизола, приблизившись к нулевому значению. Интересно, что токсичность у
соединения БИВ – 5 выросла в 3, 19 раза с 396,278±3,28 мг/кг до 124,25±8,22
мг/кг (p ≤0, 05). А уровень острой токсичности соединения БИВ-7 увеличилась
в 2, 03 раза с 790,678±8,74 мг/кг до 390,78±5,74 мг/кг (p ≤0, 05). ЛД50 остальных
соединений выросла в 1, 4 – 1, 91 раза (p ≤0, 1) (рис. 1, ряд 3).
В третьей группе животных с
интоксикацией хлоридом кадмия уровень токсичности значительно увеличился. Снова токсичность соединения БИВ-5
выросла в 4, 1 раза с 396,278±3,28 мг/кг до 96,09±0,55 мг/кг (p ≤0, 05).
Интересно, что на фоне кадмиевой интоксикации организма, в отличии от других
видов интоксикации, ЛД50 соединения БИВ-3 выросла в 3, 48 раза с 446,68±3,24
мг/кг до 128,64±3,98 мг/кг (p ≤0,1). У соединений БИВ-1, БИВ-2, БИВ-4,
БИВ-7 токсичность выросла в 2, 34 – 2, 8 раза при сопоставлении с исходным
уровнем ЛД50, проводимых на интактных животных. Уровень токсичности
соединения БИВ-6 изменился минимально, в 1, 91 раза с 1000 мг/кг до 524,01±6,21
мг/кг (p ≤0,5) (рис.1, ряд4).
Таким образом, в норме в целом все соединения
исследуемого ряда проявили очень низкий показатель острой токсичности. Острая
токсичность соединений БИВ – 4 и БИВ – 6 была ниже, чем у препарата сравнения в
21, 2 раза (p ≤0,01). Острая токсичность трех соединений БИВ – 1, БИВ –
2, БИВ – 7 лежала в диапазоне от 790,68±8,74 до 851,138±1,38 мг/кг веса
животного, что характеризовало соединения как малотоксичные. Лишь один препарат
БИВ - 5 проявил острую токсичность 396,278±3,28 мг/кг, однако и он был менее
токсичным, чем препарат сравнения в 8, 4 раза. Таким образом, в целом все
исследуемые соединения проявили низкий уровень токсичности, в диапазоне от 396,278±3,28
до более 1000 мг / кг веса животного.
Уровень
токсичности исследуемых соединений вырос при проведении опытов на
животных с острой формой интоксикации организма солями металлов. Уровень острой
токсичности новых исследуемых соединений и левамизола максимально повысился у
животных, с интоксикацией организма солью кадмия, далее уступали группы с
острой формой интоксикации сульфатом цинка и ацетатом свинца. По первой группе
животных, отравленных ацетатом свинца были получены следующие результаты.
Максимальное повышение уровня токсичности наблюдалось у препарата сравнения
левамизола. Наименьшие изменения в уровне токсичности наблюдались у исследуемых
соединений БИВ – 1, БИВ – 6. Более, чем в 3 раза изменилась острая токсичность
у соединения БИВ – 5. По второй группе животных, отравленных сульфатом цинка
была получена аналогичная картина
изменения уровня острой токсичности. Максимально высокий уровень острой
токсичности был у левамизола. Менее, чем в 1, 5 раза изменился уровень
токсичности у исследуемого соединения БИВ – 2. Острая токсичность соединений
БИВ – 7 и БИВ – 5 повысился в 2 и 3 раза соответственно, по сравнению с нормой.
Остальные соединения занимали промежуточное положение. В третьей группе
животных, с острой формой интоксикации хлоридом кадмия были получены худшие
результаты. Уровень острой токсичности практически всех соединений повысился
более, чем 2, 5 раза, по сравнению с нормой. Уровень острой токсичности
левамизола был аналогичен полученным уровням при других видах отравления солями
металлов.
Литература
1.
Меркурьева
Р.В. Метаболические механизмы биоэффектов факторов окружающей среды как основа
классификации биохимических методов по приоритетности. В сб. Современные
биохимические методы в гигиене окружающей среды. //М.: 1982. - С. 11 –32.
2. Трахтенберг И.М., Колесников В.С.,
Луковенко В.П. Тяжелые металлы во внешней среде: cовременные гигиенические и
токсикологические аспекты. //Мн.: Навука i тэхнiка, 1994. - 285 с.
3. Ревич Б.А., Свет Ю.Е., Смирнова Р.С.,
Сорокина Е.П. Методические рекомендации по геохимической оценке загрязнения
территорий городов химическими элементами.//М., 1982. – 111 с.,
4. Жолтеева С.И. О региональном
содержании тяжелых металлов//Тр. Междунар. симпозиума, посв. 100-летию со дня
рождения К.И.Сатпаева. – Алматы, 1999. – Ч.1. – С. 284 – 286.,
5. Сидоренко Г.И., Литвинов Н.И.
Современные проблемы гигиены окружающей среды и ее место в системе наук по
биосфере/Обзор информации «Медицина и здравоохранение». Серия «Гигиена». –
1986. – 48 с.,
6. Красовский Г.Н., Надеенко В.Г.,
Кенесариев У.И. Токсичность металлов в питьевой воде.//Алма-Ата, «Гылым», 1992. – 126 с.
7. Гончаров П.П., Ахметкалиев М.С..
Жакашов Н.Ж., Абишев Б.М. Влияние промышленных выбросов некоторых предприятий
химической промышленности Казахстана на загрязнение почвы.//Гигиена окружающей
среды. – Алма-Ата, 1998. - №5. – С. 18 – 22.,
8. Даутов Ф.Ф., Галямов А.Б.
Качественная и количественная характеристика загрязнения атмосферного воздуха
промышленного города. // Гигиена и санитария. – 1990. - №6. – С. 10 – 14.,
9. Неменко Б.А., Грановский Э.И.
Критерии оценки загрязнения окружающей среды тяжелыми металлами.//Метод. рекомендации.
– Алма-Ата, 1988.
10. Грановский Э.И., Неменко Б.А.
Современные методы определения тяжелых металлов и их применение для
биологического мониторинга. // Алма-Ата.- 1990. – С. 16 – 17.
11. Белозеров Е.С., Кенесариев У.И. К гигиеничекой
оценке техногенных биогеохимических провинций Республики Казахстан и их
клинико-эпидемиологическая классификация.//Сб.:Актуальне вопросы гигиены и
профпатологии в Казахстане. //Алматы, 1993. – С. 129 – 132.
12. Ревич Б.А. Свинец, ртуть и кадмий в биосубстратах
населения промышленных городов.//Микроэлементы в биологии и их применение в с/х
и медицине: Тез. докл. 11 Всесоюзн.конф. // Самарканд.- 1990. – С. 71 – 73
13. Жунусова К.Х., Шарипова М.А. Эколого
– гигиеническая оценка поступления свинца в экосистему города и его накопление
в организме.//Тр. Межд.симпозиума, посвщ. 100-летию со дня рождения К.И.Сатпаева.
– Алматы. - 1999. – С. 286 – 288.,
14. Бигалиев А.Б. Генетический эффект
солей тяжелых металлов как загрязнителей окружающей среды.//Сб.: Успехи современной
генетики. – 1982. - №10. – С. 104 – 107.
15. Абеуов Б.А. Влияние свинцовой
интоксикации на гематоэнцефалический барьер.//Сб.: Проблемы экологии и
профпатологии. – Шымкент, 1995. – С. 2 – 4.
16. Омарова М.Н., Шарбаков А.Ж.
Окружающая среда и здоровье населения.//Гигиена, эпидемиология и
иммунобиология. – 2003. - №4. – С. 15 – 20.
17. Гигиена:Учебник, 2-ое изд., перераб.
И доп./Под ред. Акад. РАМН Г.И. Румянцева. – М.:ГЭОТАР-МЕД, 2001. – 601 с.
18. Шаронов Б.П., Говорова Н.Ю., Лызлова
С.Н. Антиокислительные свойства и деградация белков сыворотки крови активными
формами кислорода (О2, ОCl-), генерируемыми стимулированными нейтрофилами. //Биохимия.-1988.- Т. 53. -вып. 5.- С. 816 – 824.
19. Dean R.T., Fu
S., Stocker R., Davies M.J. Biochemistry and pathology of radical-mediated
protein oxidation.// The Biochemical Journal. -1997.- Vol. 324.- P. 1 – 18.
20. Gaetke L.M.,
Chow C.K. Copper toxicity, oxidative stress and antioxidant nutrients.//
Toxicology.- 2003. -Vol. 189. -P. 147 – 163.
21. Pigeolet E.,
Remacle J. Susceptibility of glutathione peroxidase to proteolysis after
oxidative alteration by peroxides and hydroxyl radicals. //Free Radical Biology
& Medicine. -1991. -Vol. 11.- P. 191 – 195.
22.
Powell R. The Antioxidant Properties of Zinc. //Journal
of Nutrition. -2000.- Vol. 130. -P. 1447 – 1454.