Коровашкина А.С., Рымко А.Н., Квач С.В.,
Зинченко А.И.
Институт микробиологии НАН Беларуси, Минск
ПОЛУЧЕНИЕ И ХАРАКТЕРИСТИКА
НАНОРАЗМЕРНЫХ ЧАСТИЦ, СОДЕРЖАЩИХ ПЛАЗМИДЫ, ОБОГАЩЕННЫЕ CPG-МОТИВАМИ
Введение. Бактериальная ДНК способна активировать иммунитет человека
и животных, благодаря наличию в ее составе неметилированных CpG-динуклеотидов [1]. Созданные
с применением генно-инженерной техники препараты плазмидной ДНК (пДНК),
обогащенной CpG- динуклеотидами (CpG-пДНК), являются перспективными лекарственными
средствами, но ввиду низкой стабильности пДНК в русле крови, необходима
разработка эффективных способов её доставки в клетки-мишени. Среди кандидатов в
переносчики пДНК рассматриваются наночастицы (НЧ) на основе неорганических слоистых
двойных гидроксидов (СДГ) [2]. Структуру СДГ описывают в виде металл-гидроксидных
слоев, в которых часть дивалентных катионов изоморфно замещена на катионы
тривалентные, что приводит к возникновению на слоях положительных зарядов. Эти
заряды компенсируются за счет интеркаляции гидратированных анионов в межслойное
(галерейное) пространство [3].
В ряде работ для транспорта
лекарственных соединений предложено использовать НЧ на основе белков, таких как
человеческий сывороточный альбумин (ЧСА) и желатин, благодаря их высокой биосовместимости,
отсутствию токсичности и слабой антигенности [4].
Из ЧСА достаточно легко
получать НЧ желаемого размера [5]. Для этого используется метод десольватации
этанолом. Метод позволяет связывать различные молекулы путем встраивания,
абсорбции или посредством ковалентного связывания с поверхностью НЧ. В 2005
году НЧ на основе ЧСА, содержащие цитостатик ‒ паклитаксел, были одобрены
для практического применения Управлением по контролю качества пищевых продуктов
и лекарственных препаратов (FDA) США [6].
Целью настоящей работы явилось
получение НЧ на основе слоистых двойных гидроксидов и ЧСА и изучение
возможности получения их комплексов с CpG-пДНК.
Объекты
и методы исследования. CpG-пДНК, содержащую 96 повторов
иммуностимулирующего мотива GTCGTT, нитратную форму СДГ, а
также комплекс СДГ-пДНК, получали как описано нами ранее
[7, 8]. Для получения ЧСА-НЧ к 2 мл этанола по каплям при перемешивании
добавляли 1 мл раствора ЧСА со скоростью 1 мл/мин. К полученной суспензии белка
добавляли 20 мкл раствора 10% глутарового альдегида и инкубировали 12 ч при
перемешивании. Образовавшийся осадок собирали центрифугированием при 20 000 g в течение 20 мин [9].
Для включения пДНК в состав ЧСА-НЧ к 1 мл
2% раствора ЧСА добавляли 30 мкг плазмиды pCpG-KH11. Дальнейшее
приготовление ЧСА-НЧ проводили как описано выше.
Размер полученных НЧ определяли с
использованием прибора «Partical Size Analyzer 90Plus» («Brookhaven Instruments Co», США). Определение включения пДНК в состав НЧ проводили с помощью агарозного
гель-электрофореза.
Результаты и обсуждение. Начальный
этап работы был посвящен получению НЧ на основе СДГ магния и алюминия, а также
ЧСА. Отмытые НЧ ресуспендировали в дистиллированной воде. Получали прозрачный,
слегка опалесцирующий раствор. Результаты экспериментов по измерению размера полученных
НЧ иллюстрирует рис. 1.
Из рис. 1 видно,
что средний диаметр исследуемых частиц составляет 227,5 нм для СДГ-конструкций
и 280,3 нм для частиц на основе ЧСА.

Рис. 1. Определение размера НЧ, полученных из СДГ (А) и
ЧСА (Б)
Таким образом,
полученные частицы действительно являются наноразмерными и, следовательно,
могут быть использованы для наноструктурирования иммуностимулирующей пДНК.
На следующем
этапе изучали возможность иммобилизации пДНК в НЧ. Контроль включения плазмиды
pCpG-KH11 в СДГ- и ЧСА-НЧ проводили с помощью агарозного гель-электрофореза.
Полученные данные представлены на рис. 2. Прежде всего видно, что после включения в наноразмерные комплексы пДНК не
разделяется с носителем в агарозном геле, а остается на старте. Кроме того, из
рис. 2 следует, что вся пДНК включена в состав НЧ.
При суспендировании НЧ из ЧСА-пДНК в воде
образуется гомогенный опалесцирующий раствор, а НЧ из СДГ-пДНК формируют белые
хлопьевидные агрегаты. Мы предположили, что при включении отрицательно
заряженной пДНК в состав СДГ они теряют свой заряд и агрегируют. Следовательно,
комплексы СДГ-пДНК представляют собой агрегаты наноразмерных частиц.

Рис.
2. Электрофореграмма плазмиды pCpG-KH11 до (1) и после иммобилизации в НЧ на основе СДГ (2)
и ЧСА (3)
С другой стороны, белковые молекулы имеют
значительно более сложную структуру и при иммобилизации пДНК на НЧ на основе
ЧСА они не агрегируют и представляют собой гомогенный опалесцирующий раствор.
Из рис. 3 видно,
что размер полученных комплексов ЧСА-пДНК в среднем составляет 168,3 нм.
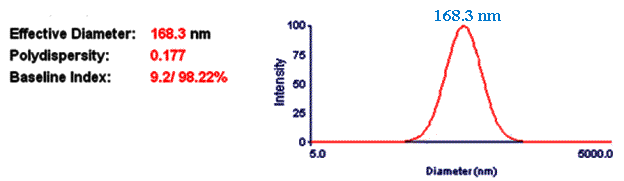
Рис. 3. Определение размера комплекса ЧСА-пДНК
Таким образом, в результате выполнения
работы получены на основе СДГ магния и алюминия, а также ЧСА наноразмерные
конструкции, содержащие плазмиду pCpG-КН11, которые
в дальнейшем могут быть использованы для изучения ее иммуностимулирующих
свойств.
Литература:
1.
Krieg, A.M. CpG motifs in bacterial DNA and their immune effects / A.M.
Krieg // Annu. Rev. Immunol. ‒ 2002. ‒ Vol. 20. ‒ P.
709‒760.
2. Choi, S.J. Anticancer drug-layered hydroxide
nanohybrids as potent cancer chemotherapy agents / S.J. Choi, J.M.
Oh, J.H. Choy // J. Phys. Chem. Solids. ‒2008. ‒Vol. 69, № 5-6.
‒P. 1528–1532.
3. Sugar–anionic clay composite
materials: intercalation of pentoses in layered double hydroxide / S.
Aisawa [et al.] // J. Solid State Chem. ‒ 2003. ‒ Vol. 174, № 2.
‒ P. 342–348.
4. Cellular uptake, antitumor response and tumor penetration of
cisplatin-loaded milk protein nanoparticles / X Zhen [et al.] // Biomaterials.
– 2013. – Vol. 34, № 4. – P. 1372–1382.
5. Human serum albumin (HSA) nanoparticles stabilized
with intermolecular disulfide bonds / W. Wang [et al.] // Chem. Commun. – 2013.
– Vol. 49. – P. 2234–2236.
6.
Phase III trial of nanoparticle albumin-bound paclitaxel compared with
polyethylated castor oil-based paclitaxel in women with breast cancer / W.J.
Gradishar [et al.] // J. Clin. Oncol. – 2005. – Vol. 23. – P. 7794–7803.
7. Коровашкина, А.С. Создание штамма Escherichia coli ‒ продуцента плазмидной ДНК, обогащенной иммунотропными СрG-мотивами / А.С. Коровашкина, С.В. Квач, А.И. Зинченко // Стремления ‒ 2011: сб. материалов II Междунар. научн.-практ. конф. мол. ученых, Минск, 14‒18 ноября 2011 г. Минск, Беларуская наука, 2011.
‒Т.1.
‒ С.
184‒187.
8. Использование комплексов слоистого двойного гидроксида для иммобилизации плазмид, обогащенных CpG-мотивами / А.Н. Рымко [и др.] // Dynamika naukowych badan – 2012:
materialy VIII Miedzynarodowej naukowi-praktycznej konferencji, Przemysl,
07–15 lipca 2012. – Vol. 19. – S. 28–32.
9. Human serum albumin nanoparticles for delivery of Cu, Zn superoxide
dismutase gene / Y. Mo [et
al.] // Mol. Vision. 2007. Vol. 13. P. 746–757.