Рымко А.Н., Коровашкина А.С., Квач А.С., Зинченко
А.И.
Институт микробиологии НАН Беларуси, Минск
ИЗУЧЕНИЕ ФИЗОКО-ХИМИЧЕСКИХ СВОЙСТВ ДЕЗОКСИНУКЛЕОЗИДКИНАЗЫ DROSOPHILA MELANOGASTER
Дезоксинуклеозидкиназа (КФ
2.7.1.145, ДН-киназа), продуцируемая клетками Drosophila melanogaster, катализирует (в отличие от бактериальных
нуклеозидкиназ) фосфорилирование всех четырех природных
2′-дезоксинуклеозидов до 2′-дезоксинуклеозид-5′-монофосфатов
[1, 2]. Широкая субстратная специфичность этого фермента открывает возможность
его использования на начальном этапе трансформации всех четырех природных
2′-дезоксинуклеозидов в необходимые для постановки ПЦР
2′-дезоксинуклеозид-5′-трифосфаты [3], а также оказывается полезной
при изучении механизма действия некоторых противоопухолевых и противовирусных
нуклеозидов.
В связи с вышеизложенным,
целью настоящей работы было создание рекомбинантного штамма Escherichia coli, продуцирующего ДН-киназу D. melanogaster
и изучение ее физико-химических свойств.
Объекты и методы исследования. Источником гена ДН-киназы (dnk;
GI:42273,
GenBank)
служила геномная ДНК D. melanogaster,
выделенная стандартным методом. Ген собрали из трех экзонов с помощью метода
перекрывающейся ПЦР с использованием Pfu-ДНК-полимеразы
(Promega,
США) и шести олигонуклеотидных праймеров: Dm-dnkF1 (5¢-CAGTAACATATGGCGGAGGCAGCATCC-3¢), Dm-dnkR1 (5¢-CGAAGCAATAGCGAGCGCTAAAAATGGAGCG-3¢), Dm-dnkF2 (5¢-TTAGCGCTCGCTATTGCTTCGTGGAGAACATGC-3¢), Dm-dnkR2 (5¢-CGAGGACTAGGACCTTGCACGACTGCGGTC-3¢), Dm-dnkF3 (5¢-TCGTGCAAGGTCCTAGTCCTCGATGCCGATCTG-3¢) и Dm-dnkR3 (5¢-ATCTCGAGTCTGGCGACCCTCTGGC-3¢) (Праймтех, Беларусь). На следующем этапе
ген dnk клонировали в векторе pET42b+
(Novagen, США) в клетках E. coli BL21(DE3) (Novagen,
США) по стандартной методике. В результате получен штамм, продуцирующий
ДН-киназу D. melanogaster,
несущую на С-конце дополнительный октагистидиновый олигопептид.
Клетки-трансформан-ты выращивали,
проводили индукцию синтеза белка 1 мМ изопропил-β-тиогалактопиранозидом и продолжали
культивирование в течение 3 ч. По окончании культивирования выделение
рекомбинантного белка из клеток проводили по стандартной методике с помощью металло-аффинной
хроматографии на смоле Ni-NTA
(Sigma-Aldrich, США) согласно инструкции фирмы изготовителя.
Активность ДН-киназы
определяли по скорости фосфорилирования дезокситимидина. Реакционную смесь,
содержащую 50 мМ Трис-НСl-буфер (рН 8,5), 15 мМ MgCl2, 100 мМ KCl, 5 мМ АТФ, 2 мМ дезокситимидин и фермент, инкубировали при 30oС. Ход реакции контролировали с помощью
ионообменной высокоэффективной жидкостной хроматографии. За единицу активности
фермента принимали такое его количество, которое обеспечивало образование 1
мкмоль продукта при 30 оС за 1 мин протекания реакции.
Результаты и обсуждение. Ген dnk, кодирующий ДН-киназу D. melanogaster, встраивали в плазмиду рЕТ42b+ под контролем сильного Т7-промотора. К
3′-концу кодирующей цепи гена добавляли нуклеотидную последовательность,
кодирующую гистидиновый октапептид, выполняющий роль аффинного домена. В
результате впервые создан штамм-продуцент рекомбинантной ДН-киназы (E. сoli КНК-12/3), молекула которой содержит дополнительный гистидиновый
октапептид. При индукции синтеза рекомбинантной ДН-киназы в клетках полученного
штамма доля ДН-киназы D.
melanogaster составила 57% от общего клеточного белка
(согласно ДСН-электрофореза).
Термостабильность биокатализатора является
ключевым фактором при подборе оптимальных условий проведения биотехнологических
синтезов. При изучении термостабильности ДН-киназы ферментный препарат
прогревали при температурах 27–42оС с шагом 5оС на
протяжении 4 ч в присутствии субстрата (АТФ) с последующим измерением остаточной
активности ДН-киназы. Результаты, полученные в эксперименте, представлены на
рисунке 1.
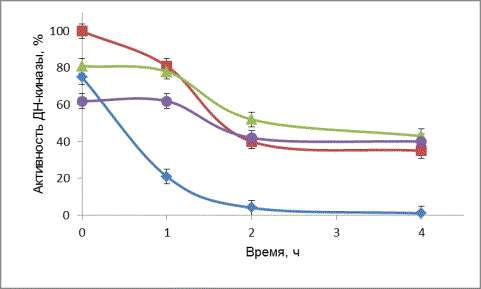
Рисунок 1. Влияние прогрева на
активность ДН-киназы
при 42оС (1), 37оС
(2), 32оС (3), 27оС (4).
Из рисунка 1 видно, что ДН-киназа быстро
инактивируется при температуре 42 оС. Свою максимальную активность фермент
проявляется при 37 оС, однако уже через 2 ч инкубирования при данной
температуре фермент теряет около 50 % своей начальной активности. Наибольшую
стабильность фермент проявляет при 27–32 оС, однако при 32 оС
активность ДН-киназы в среднем на 20 % больше.
Изучение влияния pH на активность ДН-киназы проводили в 100 мМ Трис-HCl-буфере в диапазоне значений рН 7,0–9,0. Установлено, что
максимальную активность ДН-киназа проявляет при значении рН равном 8,5, что не
совпадает с литературными данными, согласно которым оптимальное значение рН для
работы данного фермента составляет 7,5 [4, 5].
Известно, что ионы двухвалентных металлов
играют ключевую роль в функционировании каталитического центра большинства
ферментов, осуществляющих реакцию фосфорилирования. Однако данных о зависимости
активности ДН-киназы от концентрации ионов двухвалентных металлов в доступной
нам литературе нами не найдено.
Изучено влияние Mg2+, Ca2+, Mn2+, Zn2+ и Fe2+ на
активность фермента. Результаты эксперимента показывают, что наибольшей удельной
активностью ДН-киназа обладает в присутствии ионов Mg2+. Оптимальная
концентрация ионов Mg2+ для функкционирования фермента составляет 10
мМ.
Таким
образом, в результате проведенных экспериментов создан штамм E. сoli КНК-12/3 ‒ продуцент
ДН-киназы D. melanogaster.
Показано, что максимальную активность фермент проявляет при температуре 37 оС,
рН 8,5 и в присутствии ионов Mg2+ в концентрации 10 мМ. Полученные результаты открывают перспективу использования ДН-киназы для
проведения ферментативного фосфорилирования природных нуклеозидов и их производных.
Литература:
1.
Munch-Petersen, B. Four deoxynucleoside kinase activities from Drosophila melanogaster are contained
within a single monomeric enzyme, a new multifunctional deoxynucleoside kinase
/ B. Munch-Petersen, J. Piskur, L. Sondergaard // J. Biol. Chem. – 1998. – Vol. 273, N 7. – P. 3926–3931.
2.
Mikkelsen, N.E. Structural studies of nucleoside analog and feedback inhibitor
binding to Drosophila melanogaster multisubstrate
deoxyribonucleoside kinase / N.E. Mikkelsen, B. Munch-Petersen, H. Eklund //
FEBS J. – 2008. – Vol. 275. – P. 2151–2160.
3. Knecht, W. Identification of
residues involved in the specificity and regulation of the highly efficient
multisubstrate deoxyribonucleoside kinase from Drosophila melanogaster
/ W. Knecht, B. Munch-Petersen, J. Piskur // J. Mol. Biol. – 2000. –
Vol. 301, N 4. – P. 827–837.
4.
Active site mutants of Drosophila melanogaster multisubstrate deoxyribonucleoside
kinase / N. Solaroli [et al.] // Eur. J. Biochem. – 2003. –Vol. 270 N 13. – P. 2879–2884.
5. Investigation of the substrate recognition of Drosophila melanogaster
nucleoside kinase by site directed mutagenesis / N. Solaroli [et al.] // Nucleosides, Nucleotides, Nucleic Acids – 2004. – Vol. 23. –
P. 1527–1529.