Определение срока хранения
иммобилизованной глюкоамилазы и использование в реакторе периодического
действия
Макарова ЕЛ., Ковалева Т.А.
Воронежский
государственный университет, Воронеж, 394006 Университетская пл. 1
E-mail: makarova7809@mail.ru
Глюкоамилаза
(α-1,4:1,6 глюкан-4,6-глюкогидролаза, КФ 3.2.1.3) присутствует во всех
биологических объектах: в организме человека и животных, высших и низших
растений, в культурах микроскопических грибов, бактериях, катализирует реакцию
гидролиза крахмала до глюкозы, атакуя только внешние нередуцирующие концы цепей
полисахаридов, и широко используется в разработке новых прогрессивных
технологий.
При создании гетерогенных препаратов глюкоамилазы ведущим
критерием должен выступать не процент сохранения активности, а степень
прочности комплекса фермент-носитель. Применение природных биополимеров
полностью утилизируемых организмом, то есть перевариваемых и замещаемых
собственными тканями, исключает опасность накопления матрицы носителя в
организме человека. Среди других белков коллаген обладает наименьшей
иммуногенностью и его уникальные физико-химические свойства удовлетворяют
многочисленным требованиям, предъявляемым к носителям при создании новых
лекарственных препаратов.
Поэтому нами была проведена
сорбционная иммобилизация глюкоамилазы (α-1,4:1,6
глюкан-4,6-глюкогидролаза, КФ 3.2.1.3) на коллагене, выделенном ферментативным
методом из соединительной ткани крупного рогатого скота на кафедре технологии
мяса и мясопродуктов Воронежской государственной технологической акадамии.
Объектом исследования послужил фермент
глюкоамилаза из Аspergillus awamori, препарат Г20Х производства Ладыжинского
завода ферментных препаратов, подвергнутый специальным методом очистки.
Для определения активности глюкоамилазы
использовали глюкозооксидазный метод. Расчет каталитической активности
производили по формуле:
![]() ,
,
где а - количество глюкозы, образовавшейся в 1
мл гидролизата, мкг;
b- количество фермента в
1 мл гидролизата, мг/мл;
t- время гидролиза, мин;
180- молекулярная масса глюкозы.
В качестве субстрата использовали растворимый картофельный крахмал
Для осуществления сорбционной иммобилизации 5 г коллагена оставляли на ночь при
комнатной температуре в 25,6 мл ацетатного буфера (рН 4,5). 5 мл раствора
фермента (10-5 моль/л) добавляли к суспензии носителя и перемешивали
в колбе с помощью электрической мешалки в течение 1,5 часа при температуре 25°С.
Далее центрифугировали при 3000 об/мин
5 мин, осадок промывали ацетатным буфером (рН 4,5), затем
дистиллированной водой до отсутствия в промывных водах белка (контроль
осуществляли на СФ-26 при l=280 нм). Содержание белка в
иммобилизованном ферменте определяли модифицированным методом Лоури, а
каталитическую активность – глюкозооксидазным методом, причем инкубацию
иммобилизованного фермента с субстратом осуществляли при перемешивании с
помощью магнитной мешалки в течение 30 минут.
В связи с тем, что иммобилизация должна обеспечивать достаточно высокую
стойкость энзима и определять пролонгацию воздействия препарата при применении
в качестве лекарственных средств, а также легкость отделения продуктов в чистом
виде, была изучена возможность
многократного применения глюкоамилазы, иммобилизованной на коллагене в реакторе
периодического действия.
Показано, что комплекс глюкоамилаза-коллаген обладает достаточной
прочностью и не разрушался при гидролизе крахмала, при 10-кратном применении в
качестве гетерогенного катализатора реакции гидролиза крахмала. Установлено,
что при десятикратном применении каталитическая активность глюкоамилазы,
иммобилизованной на коллагене, не изменяется.
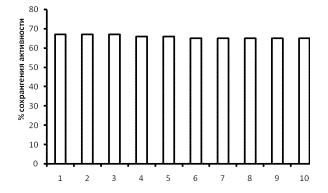
Рис. 1. Многократность применения иммобилизованной на
коллагене глюкоамилазы из Aspergillus awamori
1-
Иммобилизованный фермент после первого применения; 2- После
второго применения в качестве биокатализатора; 3- После третьего применения в
реакторе периодического действия; и так далее.
Установлено, что каталитическая активность фермента и
содержание белка в иммобилизованном на коллагене препарате, который хранился в
лабораторных условиях, не изменялись в течение 3 лет. Очевидно, фермент
достаточно прочно связывается с матрицей носителя, существенно не изменяя при
этом каталитически активной конформации, что позволяет рекомендовать коллаген в
качестве носителя и протектора низко- и высокомолекулярных веществ.