Медицина/8. Морфология
Лепейко Ю.Б., к.м.н.
Гилифанов Е.А., д.м.н. Дюйзен И.В.
Тихоокеанский
Государственный Медицинский Университет, Россия
Динамика активности MMP9 и TIMP2 в слизистой оболочке
носа у крыс при экспериментальном моделировании хронического табакокурения.
Данное
исследование посвящено изучению активности ММР9 и TIMP2 в слизистой оболочке
носа у крыс при экспериментальном моделировании хронического табакокурения.
Установлено, что в группе курильщиков происходит значительное увеличение активности
ММР9 и площади, занимаемой межклеточным ферментом. Наиболее выраженные
изменения наблюдаются в собственной пластинке слизистой, где площадь
ММР9-позитивной зоны возрастает до 64%. Изменение активности тканевого
ингибитора ММР9 (TIMP2), демонстрирует при длительной экспозиции табачного дыма
противоположную динамику. В группе курильщиков, во всех слоях слизистой
оболочки, заметно сокращается активность TIMP2-позитивной зоны, однако в
собственной пластинке слизистой обнаруживаются сгруппированные в небольшие
кластеры макрофаги, демонстрирующие невысокий уровень TIMP2. Поэтому, базируясь
на известных к настоящему времени данных о молекулярных механизмах
регулирования активности матриксных металлопротеиназ, можно считать, что
фармакологическое воздействие на данную ферментную систему позволит обеспечить
профилактику и лечение грубых морфо-функциональных расстройств слизистой
оболочки носа, неизменно встречающихся у курильщиков.
Особое место в развитии ряда патологических
процессов, в том числе в слизистой оболочке дыхательных путей, отводится матриксным
металлопротеиназам (ММР) [1]. Они играют центральную роль в обмене белков
соединительной ткани в здоровых и поврежденных органах. Соединительная ткань,
занимающая до 50% общего количества тканей в организме животных и человека,
содержит, помимо клеток, также соединительнотканный или межклеточный матрикс.
Основными компонентами матрикса являются фибриллярные белки (коллаген и
эластин) и полисахариды [1]. Современные достижения протеолитики показали, что
для нормального развития, физиологического обновления, восстановления здоровых тканей ведущими являются две группы
белков, а именно, матриксные металлопротеиназы (MMP) и их тканевые
ингибиторы (TIMP) [2, 3].
ММР – семейство из, по меньшей мере, 25 матриксных
энзимов, кальций- -и цинк-зависимых эндопептидаз, способных к деградации почти
всех компонентов внеклеточного матрикса и базальной мембраны. ММР делятся на
несколько главных подклассов: коллагеназы, желатиназы, стромализины, мембранный
тип ММР, матрилизины и другие типы [4, 2, 3]. Так, ММР1 (коллагеназа) обладает
свойством расщеплять естественные тройные спиралевидные внутритканевые
коллагены, однако не влияет на эластин. ММР2 (желатиназа А) может разрушать желатины, коллагены 4 типа,
эластин и другие матриксные протеины [5]. В свою очередь, ММР7 или матрилизин способна разрушать
фибронектин, ламинин, желатин, аггрекан и эластин, а также стимулировать
экспрессию ММР9 [6]. ММР9, в свою очередь, опосредует огромное многообразие
функциональных и патологических процессов – от адаптивного ремоделирования в
периоды роста и функциональных нагрузок до инвазии опухолей и развития
необратимых дегенеративных перестроек различных органов и тканей [7].
Субстратами ММР являются факторы роста, хемокины,
протеазы, адгезивные молекулы и компоненты внеклеточного матрикса [5, 8]. Белки
ММР экспрессируются во всех тканях, на всех этапах онтогенеза, участвуют в
механизмах ангиогенеза и апоптоза, являются единственными протеолитическими
ферментами, способными денатурировать фибриллярные коллагены [4]. Синтез
металлопротеиназ стимулирует факторы роста, гормоны, цитокины, адгезивные
молекулы, компоненты внеклеточного матрикса и активные формы кислорода [5]. Уровень
экспрессии ММР контролируют особые белки – факторы транскрипции. Большая часть
энзимов секретируется в межклеточное вещество в форме неактивных проферментов;
в их активации принимают участие молекулы и ферменты межклеточного матрикса [3].
Гиперпродукция ММР сопровождает многие патологические процессы
– рост и инвазию опухолей, ангиогенез и функциональное ремоделирование сосудов,
артриты, атеросклероз, эмфизема легких и др. [2, 3]. Считается, что основным
источником ММР при воспалении являются нейтрофилы, эозинофилы, тучные клетки,
макрофаги [3, 9].
Тканевые ингибиторы матриксных металлопротеиназ (TIMP) являются главными эндогенными
ингибиторами ММР в тканях, и выполняют центральную функцию в поддержании баланса
их протеолитической активности [8, 3]. Они подразделяются на тканевые и
плазматические [4]. По мнению R. Pawankar, специфическое взаимодействие между
ММР и TIMP является
ключевым моментом регуляции ремоделирования тканей [6]. У млекопитающих существует
четыре известных TIMP, которые ингибируют все ММР в соотношении 1:1,
посредством сильной ковалентной связи [10]. TIMP имеют молекулярные массы в пределах
21 кDa
(негликозированные) до 27,5 кDa (гликозированные). TIMP1 связываются с С-концевым доменом
металлопротеиназ. TIMP2 вырабатываются и присоединяются к ММР2 в
фибробластах, а также участвуют в соединении прометаллопротеиназы2 с
поверхностью клетки, где энзим активируется мембранным типом ММР1. Кроме
вышеуказанных свойств, TIMP способны участвовать в про - и антиапоптотической деятельности, и сокращении
роста опухоли [3, 8].
В целом поддерживаемый организмом баланс протеолитических
и антипротеолитических механизмов осуществляется большой группой ферментов
межклеточного матрикса; в отдельных органах и тканях набор этих ферментов
является весьма специфическим. И напротив, каждому патологическому процессу
присущ определенный набор экспрессируемых и депрессируемых ферментов
межклеточного матрикса. С выявлением клеточно-молекулярных особенностей данного
патофизиологического механизма связывают большие перспективы в создании
высокоселективных лекарственных препаратов. Табачный дым, как весьма
агрессивный фактор внешней среды, способен приводить к патологическому
ремоделированию органов дыхательной системы за счет изменения функций ММР [7,
3]. В ряде работ показана роль отдельных типов ММР при развитии
никотин-ассоциированной патологии легких и бронхов. Однако роль ММР в развитии
структурных и функциональных перестроек слизистой оболочки верхних дыхательных
путей при хроническом табакокурении до настоящего времени изучена весьма
фрагментарно.
Цель настоящей работы состояла в исследовании
активности ММР9 и ее тканевого ингибитора TIMP2 в слизистой оболочке полости носа
крыс, подверженных влиянию табака.
Материалы и методы: У крыс (N 25), весом около 350г, формировали
модель хронического табакокурения путем дозированной подачи табачного дыма в
специализированные камеры в течение 9 месяцев (по одной пачке сигарет
ежедневно). Контролем служили интактные животные (N20). Локализацию и уровень
активности ММР9 и TIMP2 в тканях слизистой оболочки полости носа осуществляли
с помощью общеморфологических и иммуноцитохимических (ИЦХ) методов.
В работе для
проведения иммунопероксидазной реакции использованы следующие первичные
антитела: anti-MMP9 - rabbit polyclonal, ThermoScientific, rb-9234-p, 1:200), anti TIMP2 – (rabbit
polyclonal, Abcam, ab61224,1:100), биотинилированные вторичные антитела (ThermoScientific),
стрептавидин-пероксидаза (ThermoScientific) и хромоген (Peroxidase Substrate Kit, Vector
NovaRED, SK - 4800). Проведение иммунопероксидазной реакции проводилось на
парафиновых срезах толщиной 10 мкм согласно стандартной методике. Инкубация с
первичными антителами осуществлялась при температуре 40С, обработка
вторичными антителами и хромогеном проводилось в соответствии с рекомендациями
фирм-производителей. Для анализа морфологических изменений тканей и проведения
подсчета числа иммунопозитивных элементов
некоторые параллельные препараты после окраски хромогеном докрашивались
гематоксилин-эозином по стандартной методике.
Для оценки тканевого
распределения и активности иммунопероксидазной реакции использовали методы
количественного и полуколичественного анализа. Об уровне активности исследуемых
ферментов в образцах слизистой оболочки мы судили по количеству ММР9-позитивных
клеток в отдельных тканевых элементах, их процентному содержанию, а также
площади (в процентах), занимаемой образующимся продуктом иммуногистохимической
реакции в отдельных слоях слизистой оболочки. Оценка количества окрашенных
клеток производилась на каждом срезе в 10 неперекрывающихся полях зрения
(объектив х40 и окуляр х10) с использованием микроскопа AxioScope A1 (Carl Zeiss). Определение площади
иммуногистохимического окрашивания осуществляли с использованием программы ImageJ 4.0 после получения
изображения с помощью камеры AxioCam ICc3 Rev.3 (Carl Zeiss). Морфометрия проводилась
на срезах, не докрашенных гематоксилин-эозином.
Результаты
исследования и их обсуждение.
Распределение иммуногистохимической активности ММР9 в слизистой оболочке полости
носа у животных контрольной группы соответствует местам расположения рыхлой
волокнистой соединительной ткани (Рис.1). Фермент локализован в собственной
пластинке, слизистой и подслизистой основе. Во всех случаях иммуноцитохимическая
метка на ММР9 распределяется в виде тонкой полоски непосредственно под эпителиальными
слоями - под базальной мембраной мерцательного эпителия, в собственной
пластинке и под базальной мембраной секреторных эпителиоцитов, желез в подслизистой
основе (Рис. 1А). В норме площадь, занимаемая межклеточно расположенным ферментом в соединительнотканных
слоях слизистой оболочки, занимает не больше 18% (см. табл.). В некоторых
случаях в собственной пластинке слизистой выявляются одиночно расположенные
тучные клетки, содержащие продукт иммуногистохимической реакции. Кровеносные сосуды соединительнотканных
слоев слизистой оболочки также окружены тонкой прослойкой ММР9-содержащей
ткани, эндотелий сосудов фермента не содержит (Рис. 1В).
В группе курильщиков заметно возрастает
активность ММР9 и площадь, занимаемая межклеточным ферментом. Наиболее
выраженные изменения наблюдаются в собственной пластинке слизистой (Рис. 1Б),
где площадь ММР9-позитивной зоны возрастает до 64%. В кровеносных сосудах
подслизистой оболочки (преимущественно в артериях среднего диаметра), в
эндотелиальных клетках возникает экспрессия фермента (Рис. 1Г – указано
стрелкой). Возрастает и количество тучных клеток с активностью ММР9 (см. табл.);
чаще всего они располагаются не равномерно, а в виде очаговых скоплений.
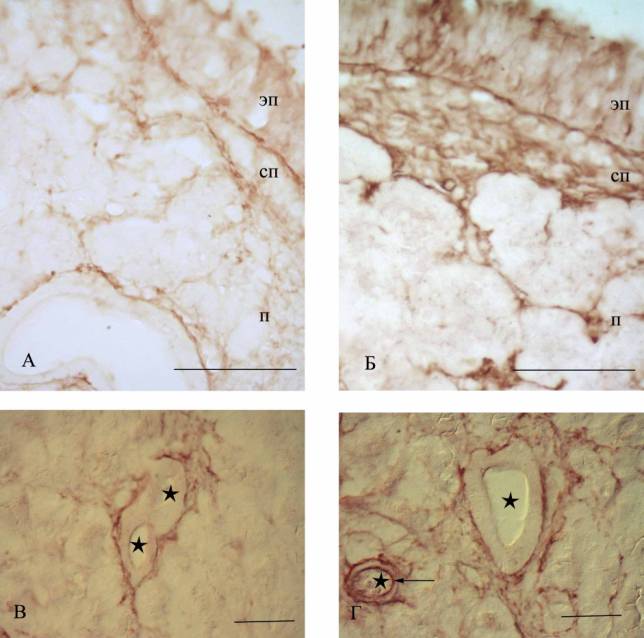
Рисунок
1. Распределение активности MMP9 в слизистой оболочке
носа интактных животных (А, В) и крыс с моделью хронического табакококурения
(Б, Г). В, Г – микрофотографии MMP9-позитивных элементов
сосудистого русла собственной пластинки слизистой оболочки с использованием
фазового контраста. Условные обозначения: эп – эпителиальный слой, сп – собственная
пластинка слизиситой, п – подслизистая основа. Зведочками на рис. В и Г указаны просветы сосудов. Масштаб: А, Б
– 200 мкм, В, Г – 50 мкм.
Таблица. Изменение активности ММР9 и TIMP2
в тканях слизистой оболочки носа у крыс-курильщиков и интактных животных:
|
|
Площадь иммунопозитивной зоны в подслизистой
(в % от обшей площади) |
Количество иммуно-позитивных тучных клеток
в (в 100000 мкм2 ткани) |
Площадь
иммуно-позитивной зоны в эпителии (в % от общей площади) |
|
ММР9 |
|||
|
Контрольная группа |
18,07±1,14 |
6,08±1,01 |
|
|
Основная группа |
64,01±2,71 |
27,13±1,14 |
|
|
TIMP1 |
|||
|
Контрольная группа |
31,43±2,001 |
|
26,35±2,91 |
|
Основная группа |
15,03±1,08 |
|
4,76±1,06 |
Активность TIMP2 в слизистой оболочке полости
носа у животных контрольной группы сосредоточена как в соединительнотканных
пластах, так и в клетках мерцательного эпителия (Рис. 2А). В последнем случае
фермент локализуется, преимущественно, в апикальных слоях эпителиоцитов. Здесь
площадь, занимаемая TIMP2-позитивной зоной, составляет 31%; в собственной
пластинке слизистой активность фермента невысока, в соединительной ткани подслизистой
основы TIMP2-позитивная зона занимает 59% площади ткани (см. табл.). Эпителиоциты
желез подслизистой основы фермента не содержат.
Изменение активности тканевого ингибитора ММР9
(TIMP2), демонстрирует при длительной экспозиции табачного дыма противоположную
динамику (см. табл.). В группе курильщиков во всех слоях слизистой оболочки
заметно сокращается активность TIMP2-позитивной зоны, однако в собственной пластинке
слизистой обнаруживаются сгруппированные в небольшие кластеры макрофаги,
демонстрирующие невысокий уровень TIMP2 (рис. 2Б - указаны стрелками).
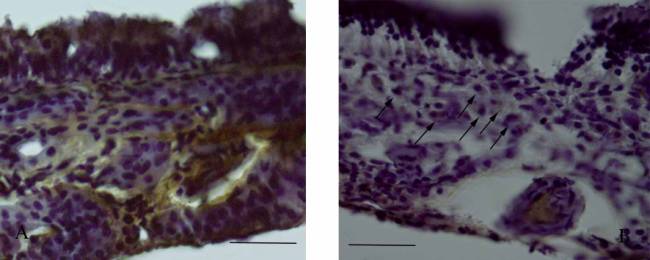
Рисунок
2. Распределение иммуногистохимической активности TIMP2 в тканях слизистой
оболочки носа крыс контрольной группы (А) и группы курильщиков (Б). На рисунке
Б стрелками указаны TIMP2 – иммунопозитивные макрофаги. Масштаб
100мкм.
Таким образом, длительная экспозиция табачного
дыма, как показано в нашем исследовании, приводит к значительному изменению
активности ферментов, участвующих в регуляции структурных и функциональных
свойств межклеточного вещества. Выраженная активация ММР9 во всех слоях
слизистой оболочки и экспрессия фермента эндотелиальными клетками сосудов происходит
на фоне значительного снижения активности эндогенного ингибитора фермента –
TIMP2. Данный метаболический дисбаланс может лежать в основе структурного
ремоделирования стенки дыхательных путей, приводя к глубоким функциональными
расстройствам. К настоящему времени, известны данные о сходной динамике
активности металлопротеиназ в периферических отделах дыхательной системы при
длительном табакокурении [8]. Активация ММР9 и усиление его протеолитической
активности в отношении белков межклеточного матрикса и снижение ингибиторных
свойств TIMP1 является важнейшим фактором патогенеза хронической
обструктивной болезни легких [7]. В нашем исследовании впервые показано, что
слизистая оболочка верхних дыхательных путей, подвергаясь хронической
интоксикации табачным дымом, претерпевает сходные метаболические перестройки.
Кроме того, мы обнаружили, что наряду с усилением ферментативной активности ММР9
в местах его естественного синтеза (соединительнотканных прослойках) при
курении происходит индукция фермента в эндотелиоцитах сосудистого русла.
Это может обуславливать нарушения микроциркуляции за счет изменения
вазомоторного тонуса.
В целом дальнейшее и более детальное исследование
функции ММР и их ингибиторов при заболеваниях органов дыхания позволит
взглянуть под другим углом на патогенетические процессы, проходящие в слизистой
оболочке, оценить результативность и безопасность проводимого медикаментозного
лечения, выработать эффективные профилактические мероприятия. Учитывая тот
факт, что ММР, в зависимости от уровня эндогенной активности, могут играть в
тканях противоположную роль, регулируя
тканевой гомеостаз и иммунную защиту в норме и приводя к глубоким
деструктивным изменениям ткани в условиях патологии [8, 12].
При этом, базируясь на известных к настоящему
времени данных о молекулярных механизмах регулирования активности матриксных
металлопротеиназ, можно считать, что фармакологическое воздействие на данную
ферментную систему позволит обеспечить профилактику и лечение грубых
морфо-функциональных расстройств слизистой оболочки носа, неизменно
встречающихся у курильщиков [5, 9, 12, 13, 14].
Список
литературы:
1.
Соловьева
Н.И., Рыжакова О.С. Методы определения активности матриксных металлопротеиназ. // Клиническая
лабораторная диагностика. – 2010. - № 2. – С. 17 – 21.
2.
The expression of MMP-2, MMP-7,
MMP-9, and TIMP-1 in chronic rhinosinusitis and nasal polyposis / I.H. Can [et
al.] // Otolaryngol Head Neck Surg. - 2008. - Vol.139, № 2. – Р. 211 – 215.
3.
Ziora D., Dworniczak S, Kozielski J.
Induced sputum metalloproteinases and their inhibitors in relation to exhaled
nitrogen oxide and sputum nitric oxides and other inflammatory cytokines in
patients with chronic obstructive pulmonary disease. // J Physiol Pharmacol. - 2008. - Vol.59, № 6.
– Р. 809 – 817.
4.
Соболева
Г.М., Сухих Г.Т. Семейство матриксных металлопротеиназ: общая характеристика и физиологическая роль. //
Акушерство и генекология. – 2007. - № 1. – С. 5 – 7.
5.
Роль
матриксных металлопротеиназ при воспалительных заболевания легких / Я.Н. Шойхет
[и др.]. // Проблемы клинич. медицины.
– 2008. - № 3. – С. 99 – 101.
6.
Pawankar R., Nonaka М. Inflammatory mechanisms and remodeling in chronic rhinosinusitis and
nasal polyps. // Curr Allergy Asthma Rep. – 2007. - Vol.7, № 3. – Р. 202 – 208.
7. Immunohistochemical study of lung remodeling in mice exposed to
cigarette smoke Samuel Santos Valença, Luís
Cristóvão Porto J Bras Pneumol. 2008; 34(10):787-795.
8.
Atkinson
Jeffrey J. and Senior Robert M. Matrix Metalloproteinase-9 in Lung Remodeling
Am. J. Respir. Cell Mol. Biol. Vol. 28, pp. 12–24, 2003.
9.
Role of matrix metalloproteinases in
chronic rhinosinusitis / K. Kostamo [et al.] // Curr Opin Allergy Clin Immunol.
– 2008. – Vol.8, № 1. - Р. 21 – 27.
10.
Eosinophil inflammation of nasal
polyp tissue: relationships with matrix metalloproteinases, tissue inhibitor of
metalloproteinase-1, and transforming growth factor-beta1 / Y.M. Lee [et al].
// J Korean Med Sci. – 2003. –Vol.18, № 1. - Р.97
– 102.
11.
Attenuation of dextran sodium
sulphate induced colitis in matrix metalloproteinase-9 deficient mice / A.
Santana [et al.] // World J Gastroenterol. – 2006. - Vol.28, № 12. – Р. 6464 – 6472.
12.
Eosinophil inflammation of nasal polyp tissue: relationships with
matrix metalloproteinases, tissue inhibitor of metalloproteinase-1, and
transforming growth factor-beta1 / Y.M. Lee [et al]. // J Korean Med Sci. –
2003. –Vol.18, № 1. - Р.97 – 102.
13.
Increased expression of matrix metalloproteinase-9 in nasal polyps
/ E. Lechapt-Zalcman [et al.] // J
Pathol. – 2001. – Vol.193, № 2. - Р. 233 – 241.
14.
Nasal polyposis: a cellular-based approach to answering questions
/ A.B. Rinia [et al.] //Allergy. – 2007. -
Vol.62, №4, - Р. 348 – 358.