Магистр физики Дунский М.М.
Костанайский государственный
университет имени А.Байтурсынова
Области применения твёрдых электролитов
Развитие
электроэнергетики в значительной степени определяется уровнем достижений в
области электропроводящих материалов. Все вещества по своей
удельной электрической проводимости условно делятся на три группы: проводники (106-108
Ом-1·м-1), полупроводники (область, лежащая
между 10-8-106 Ом-1·м-1) и
диэлектрики (ниже 10-8 Ом-1·м-1).
Проводники, в свою очередь, могут быть первого и второго рода. Проводниками второго рода называются
вещества, прохождение через которые электрического тока вызывает передвижение
вещества в виде ионов и химические превращения в местах входа и выхода тока
(электрохимические реакции). Типичными проводниками 2 рода являются растворы
солей, кислот и оснований в воде и некоторых других растворителях,
расплавленные соли и некоторые твёрдые соли. Однако, существует большое (и
возрастающее) семейство ионных твёрдых тел, в которых определённые ионы
проявляют необычайно высокую подвижность. В некоторых случаях быстрый ионный
транспорт сопровождается также заметной ионной проводимостью. Ионпроводящие материалы с высокой ионной
проводимостью в последние годы привлекают всё большее внимание. Их называют
суперионными проводниками или твёрдыми
электролитами. В науке и
технологии твёрдые электролиты представляют огромный интерес с точки зрения их
потенциального использования в качестве электродов или электролитных материалов
в устройствах электрохимических превращениях энергии и др.
Рассмотрим некоторые
области применения протонных
электролитов:
ü
электрохимические
устройства (ячейки)
ü
создание новых
типов источников тока
ü
топливные
элементы
ü
электрохромные
твердотельные дисплеи
ü
водородные
насосы
ü
датчики
парциального давления газов
ü
электрлизеры
для получения водорода
ü
реакции
(де)гидридорования
ü
электрохимические
датчики и преобразователей
ü
сверхъёмкие
конденсаторы (ионисторы)
ü
исследование
твёрдофазных реакций
ü
газовые
сенсоры
ü
катодные
материалы электролиты
ü
селективная
проводимость по катионам и анионам
ü
кислород-проводящие
материалы для конверсии природного газа
Химическим источниками тока называют электротехнические устройства, в которых
энергия химической окислительно-восстановительной реакции непосредственно
превращается в электрическую энергию. Существует три основных вида химических
источников тока: первичные, вторичные и топливные элементы:
Ø
первичные –
устройства, которые допускают лишь однократное использование заключённых в них
активных материалов
Ø
вторичные –
устройства, работоспособность которых после разряда может быть восстановлена
путём заряда
Ø
топливный
элемент – химический источник тока, в котором реагенты (топливо, т.е.
окислитель и восстановитель) непрерывно и раздельно подводятся к электродам
В последнее время появились элементы с
твёрдыми электролитами. Большинство успешных приложений твёрдых электролитов –
в твёрдотельных батареях (рис. 1). Можно различать два вида батарей: 1.
Маленькие первичные ячейки, в которых главным является время жизни и отсутствие
саморазряда, и 2 перезаряжаемые вторичные батареи, в которых главным критерием
является высокая плотность энергии. Батарея первого типа, которая используется
как регулятор сердечной деятельности, основана на литий-иодидном твёрдом
электролите. Здесь требованием является низкая мощность и непрерывное
функционирование в течение длительного времени (порядка 15 лет). Батареи с
высокой плотностью энергии важны с точки зрения альтернативных источников
энергии. Основной недостаток этих батарей состоит в использовании расплавленных
натрия и серы, которые на воздухе и во влажных условиях опасны.
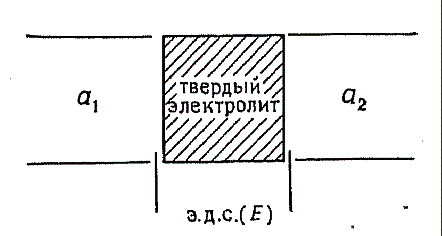
Рис. 1 Электрохимическая ячейка с твёрдым электролитом. а1 и а2 –
электродные пространства, которые могут содержать твёрдые фазы, жидкости или
газообразные вещества одинаковой или различной химической природы
Низкотемпературные первичные химические
источники тока (батареи) с твёрдыми электролитами являются очень компактными;
они используются в часах, в запоминающих устройствах, в медицинских приборах.
По конструкции эти элементы могут быть таблеточными или плёночными. В элементах
таблеточного типа твёрдый электролит прессуется из порошков исходных
материалов. Кроме того, ТЭЛ одновременно выполняет роль сепаратора.
В качестве электрохимических систем для
низкотемпературных ХИТ с ТЭЛ в основном используются системы типа
Ag-серебропроводящий электролит-катод-галогеноноситель и Li-литийпроводящий
электролит-кактод-галогеноноситель.
К вторичным химическим источникам тока
относятся аккумуляторы. Наиболее известны серно-натриевые аккумуляторы с
натрий-проводящим твёрдым электролитом (бета-глинозём), разрабатываемые для
применения в электромобилях. Аккумулятор с твёрдым электролитом схематически
изображён на рис. 2
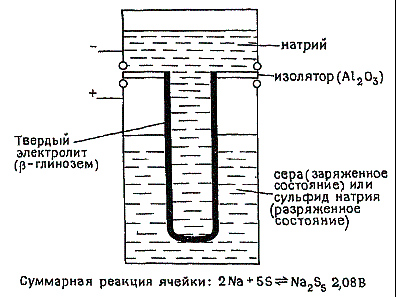
Рис. 2 Серно-натриевая ячейка с твёрдым
электролитом
Одно из самых ранних применений твёрдых
ионных проводников – использование стабилизированного диоксида циркония в
качестве электролита в высокотемпературных топливных элементах. Принципиально
доказана возможность использования некоторых видов топлива в топливных
элементах и превращения их химической энергии в электрическую с практическим
кпд до 75-90%. Однако, вследствие разных технологических и эксплуатационных
трудностей (недостаточная длительность работы, повышенные требования к чистоте
топлива) экономические преимущества топливных элементов, даже с учётом более
высокого кпд использования топлива, пока ещё не ясны.
Главное ограничение топливного элемента
– высокая элемента, высокая рабочая температура (более 1000 К). Ключ к решению
проблемы в целом лежит в нахождении подходящего электролитного материала,
который может функционировать при довольно низких температурах (400-600 К).
Предпринимаются попытки в направлении развития твёрдых протонных проводников;
сообщается, что в HNb3 и уранилфосфат являются хорошими протонными
проводниками.
Разработка топливных элементов
находится ещё в начальной стадии.
Твёрдые электролиты используются для развития электрохромных
дисплеев. WO3 – бледно-жёлтый порошок, который становится
тёмно-голубым при поглощении небольшого количества натрия с образованием NaxWO3. Поскольку обмен идёт обратимо и очень быстро, вещество используется в
дисплеях.
На основе примесных электролитов
сконструированы датчики для определения содержания кислорода в ходе некоторых
металлургических процессов.
В связи с большими перспективами
промышленного использования протонных твердых электролитов, способных
эффективно функционировать при обычных условиях, поиск новых суперпротоников
привлекает все большее внимание исследователей. К тому же, синтез новых
протонных проводников является важной задачей как с точки зрения изучения
механизма протонного переноса в конденсированном состоянии, так и с точки
зрения понимания структурных особенностей, определяющих процессы ионного
транспорта.
Суперионные проводники являются объектами
интенсивного изучения в связи с использованием в химических источниках тока,
датчиках концентрации, ионисторах и т.д. Однако, наряду с прикладными
исследованиями, остается актуальным и исследование природы аномально быстрой
диффузии в твердых телах, так как пока нет теории объясняющей ее с единых
позиций в разных классах суперионных проводников (кристаллы, стекла, полимеры и
т.д.)
На сегодняшний день поиск и
исследование новых материалов, обладающих высокой ионной проводимостью,
является одним из перспективных направлений физики и химии конденсированного
состояния.
Литература:
1. Hagenmuller, van
Gool, 1978; Chandra, 1981; Goodenough, 1984
2. Иванов-Шиц
А.К., Мурин И.В. Ионика твёрдого тела: В 2 т. Т. 1. – СПб.: Изд-во С.-Петерб.
Ун-та, 2000. – 616 с.
3. Киреев
В.А. Краткий курс физической химии. – М.: Изд-во Химия, 1970 – 639 с.
4. Прикладная
электрохимия. Учеб. для вузов./Под ред.
докт. техн. наук проф. А.П. Томилова. – 3-е изд., перераб. – М.: Химия, 1954. –
520 с.
5. Прикладная
электрохимия. Учеб. для вузов./Под ред.
проф. Н.Н. Федотьева. – Л.: гос. науч.-техн. изд-во хим. лит-ры, 1962. – 640 с.
6. Физическая
химия. В 2 кн. Кн. 2. Электрохимия. Химическая кинетика и катализ: Учеб. для вузов/
Под. Ред. К.С. Краснова – 3-е изд., испр. – М.: Высш. шк., 2001. – 319 с.
7. Физическая
энциклопедия. В 5-и томах. Под ред. Прохорова. – М.: Советская энциклопедия,
1988
8. Химическая
энциклопедия – М.: Советская энциклопедия, 1988
9. Черняк
А.В. Автореферат диссертации на соискание учёной степени кандидата химических
наук. – Черноголовка. 2006
10.
Чеботин В.Н. Физическая химия твёрдого тела. – М.Химия, 1982. – 320 с.