Постол Н.А.
Запорізький
державний медичний університет
Синтез 5-(піридин-3-іл)-4R1-1,2,4-тріазол-3-тіонів
та 3-[5-(алкілтіо)-4R1-1,2,4-тріазол-3-іл]піридинів
Як вихідні
речовини для синтезу S-алкілтіопохідних 1,2,4-тріазол-3-тіонів нами
використовувались 5-(піридин-3-іл)-2Н-1,2,4-тріазол-3-тіон
та 4-феніл-5-(піридин-3-іл)-1,2,4-тріазол-3-тіон, які отримані нами за
аналогічними в літературі методами.
Для синтезу 5-(піридин-3-іл)-2Н-1,2,4-тріазол-3-тіону (2.3) та
4-феніл-5-(піридин-3-іл)-1,2,4-тріазол-3-тіону (2.4) ми використовували
піридин-3-карбонову кислоту, яка під дією етанолу, в присутності сульфатної
кислоти, перетворюється в естер.
Дією на етиловий естер піридин-3-карбонової кислоти гідразин гідрату, в середовищі етанолу, отримують гідразид піридин-3-карбонової
кислоти. Останній вступає в реакцію з калій
тіоцианатом в кислому середовищі з утворенням
2-(піридин-3-іл)-1-гідразинокарботіоаміду або з фенілізотіоцианатом в
середовищі етанолу з утворенням відповідного 2-(піридин-3-іл)-N-феніл-1-гідразинокарботіоаміду.
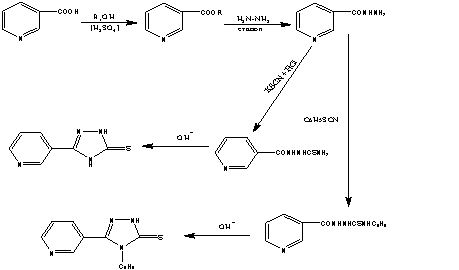 Замикання тріазолового циклу проходить в лужному
середовищі, при цьому нами отримані 5-(піридин-3-іл)-2Н-1,2,4-тріазол-3-тіон та
4-феніл-5-(піридин-3-іл)-1,2,4-тріазол-3-тіон (рись 1).
Замикання тріазолового циклу проходить в лужному
середовищі, при цьому нами отримані 5-(піридин-3-іл)-2Н-1,2,4-тріазол-3-тіон та
4-феніл-5-(піридин-3-іл)-1,2,4-тріазол-3-тіон (рись 1).
Рис. 1. Схема синтезу
5-(піридин-3-іл)-2Н-1,2,4-тріазол-3-тіону (2.3) та
4-феніл-5-(піридин-3-іл)-1,2,4-тріазол-3-тіону (2.4).
Отримані тіони являють собою світло жовту та білу кристалічні речовини,
розчинні в розчинах лугів, мінеральних кислот та органічних розчинниках.
Будова отриманих сполук підтверджена за
допомогою елементного аналізу і спектрально.
В ІЧ-спектрах сполук виявлено чіткі смуги
коливання NH-груп в межах 3500-3330см–1 та груп C=N- в межах 1660-1510см–1, а також смуги коливання пиридинового циклу при 1500-1480см–1. При 1220-1180см–1 виявлені валентні коливання груп
С=S. Крім того в ІЧ-спектрі сполуки наявна інтенсивна полоса коливання
ароматичного кільця при 1480-1440см–1. Нами вивченні
електронні спектри: 5-(піридин-3-іл)-2Н-1,2,4-тріазол-3-тіону,
4-феніл-5-(піридин-3-іл)-1,2,4-тріазол-3-тіону, 3-[5-(пропілтіо)-2Н-1,2,4-тріазол-3-іл]-піридину,
3-[5-(октилтіо)-4-феніл-1,2,4-тріазол-3-іл]піридину.
Для вирішення
питання про напрям реакції алкілування 5-(піридин-3-іл)-4R1-1,2,4-тріазол-3-тіонів нами проведено
квантово-хімічні розрахунки 5-(піридин-3-іл)-2Н-1,2,4-тріазол-3-тіону та
4-феніл-5-(піридин-3-іл)-1,2,4-тріазол-3-тіону за методом Хюкеля.
Дані
теоретичних розрахунків дозволяють припустити, що алкілування тіонів повинно
проходити по атому сірки з утворенням відповідних S-похідних. Алкілування
5-(піридин-3-іл)-2Н-1,2,4-тріазол-3-тіону та 4-феніл-5-(піридин-3-іл)-1,2,4-тріазол-3-тіону
галоїдними алканами (етилбромід, пропілхлорид, ізопропілхлорид, амілбромід,
ізоамілйодид, гептилйодид, октилйодид, децилхлорид) проводилось нами [107, 108, 155, 135, 136, 172] в середовищі етанолу в
присутності еквімолекулярної кількості натрій гідроксиду. Алкілування тіонів
етиламінобромід гідробромидом та диетиламіноетилхлориду гідрохлоридом
проводилось в аналогічних умовах, але без додавання лугу. Реакційну суміш
нагрівають до нейтрального середовища, фільтрують, розчинник випаровують,
отримують сполуки.
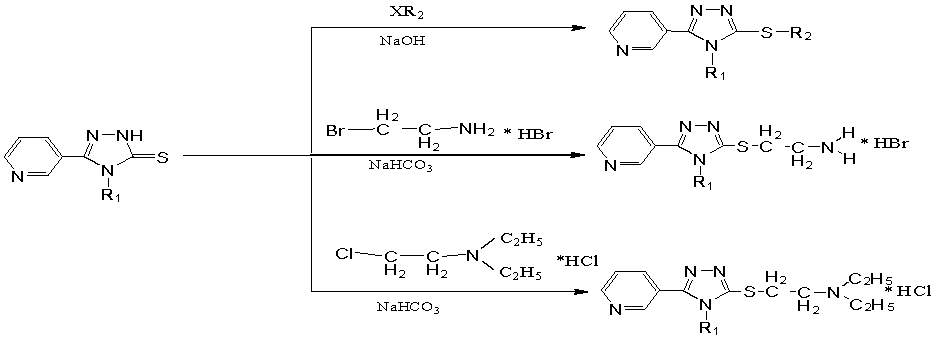
X=Cl, Br, I; R1=H, феніл; R2=Alk
Рис. 2. Схема алкілування
5-(піридин-3-іл)-2Н-1,2,4-тріазол-3-тіону та
4-феніл-5-(піридин-3-іл)-1,2,4-тріазол-3-тіону.
Синтезовані
сполуки являють собою білі, світло жовті, жовті, коричневу кристалічні речовини мало розчинні в воді,
розчинні в органічних розчинниках. Для аналізу 3-[5-(алкілтіо)-4R1-1,2,4-тріазол-3-іл]піридини
очищені з
суміші метанол: вода, 1:1, суміші етанол: вода, 1:1 (2.11-2.14), суміші етанол:
хлороформ, 1:1 (2.8), та з н-пропанолу (2.9).
Для
підтвердження індивідуальності сполук нами використаний метод тонкошарової
хроматографії в різних системах розчинників [139]. В дослідах використовувались
системи розчинників.
Сполуки
являють собою індивідуальні речовини, що підтверджено за допомогою тонкошарової
хроматографії в системах розчинників.
Література:
1. Берхин Е.Б. Методы изучения действия новых
химических соединений на функцию почек
// Хим.-фармац. журн. — 1977. — Т. 11, № 5. — С. 3—11.
2.
Бранд Дж., Эглинтон Г. Применение спектроскопии в
органической химии. - М.:
Мир, 1967.-280 с.
3.
Кныш Е.Г.
Синтез, физико-химические и биологические свойства N- и S‑замещенных 1,2,4-триазола: Дис. …д-ра фармац. наук. - Х., 1987.- 350 с.
4.
Казицына Л.А. Применение УФ-, ИК-,
ЯМР- и МАСС-спектроскопии в органической химии. - 2-е изд., перераб. и доп.-
М.: Изд-во. Моск. ун-та, 1979.- 236 с.
5. Парченко
В.В., Панасенко А.И., Кныш Е.Г Синтез и биологическая активность некоторых
алкилпроизводных 5-фуран-2-ил-4-фенил-2,4-дигидро-(1,2,4)-триазол-3-тионов // Актуальні питания фармац. та мед. науки та
практики: Зб. наук. ст. — Запоріжжя, 2005. — Вип. ХІV, — С. 263-266.
6. Парченко
В.В., Панасенко А.И., Кныш Е.Г. Синтез и биологическая активность S-замещенных
5-(2-фурил)-2,4-дигидро-1,2,4-триазол-3-тиона // Актуальні питания фармац. та
мед. науки та практики: Зб. наук. ст. — Запоріжжя, 2004. — Вип. ХІII, — С. 241-244.
7. Поиск биологически активных соединений
среди 2-[(5-пиридил)-1,2,4-тиазол-3-илтио]-уксусной
кислоты и ее производных / Ю.В. Маковик, А.И. Панасенко, Е.Г. Кныш и др. // Материалы Всеукр. науч. – прак.
конф. с междунар. участием «Лекарства - человеку». – Х., 2004. – С. 96 - 97.
8. Поиск
биологически активных веществ среди производных 3-R-1,2,4-триазолин-5-тионов / А.И.
Панасенко, В.В. Парченко, Ю.В. Маковик и др. // Актуальні питания фармац. та
мед. науки та практики: Зб. наук. ст. — Запоріжжя, 2003. — Вип. Х. — С. 77.
9.
Препаративная органическая химия / Пер с польск. В.В. Шпанова и
В.С. Володиной; Под ред. Н.С. Вульфсона.- М.: Хим. лит., 1959.- 888 с.
10. Свердлова О.В. Электронные спектры в
органической химии. — Л.: Химия, 1973. — 98 c.
11. Свердлова О.В. Электронные спектры в
органической химии. — 2-е изд., перераб. — Л.: Химия, 1985. — 128 с.
12. Синтез биологически активных веществ на
основе 3-моно и 3,4-дизамещенных 1,2,4-триазолин-5-тионов / А.И. Панасенко,
В.В. Парченко, Ю.В. Маковик и др. // Актуальні питания фармац. та мед. науки та
практики: Зб. наук. ст. — Запоріжжя, 2003. — Вип. Х, — С. 77.
13.
Синтез, физико-химические свойства и биологическая активность
производных 5-(2-фурил)-2,4-дигидро-1,2,4-триазол-3-тиона / В.В. Парченко А.И.
Панасенко, Е.Г. Кныш и др. // Междунар. сб. науч. тр. по созданию и
апробации новых лек. средств «Лекарства — человеку». — X.,2004. — С. 111-112.
14. Физические методы в химии
гетероциклических соединений / Под ред. А.Р. Катрицкого. — М.; Л., 1966. — 371 с.
15.
Чепель П.В.
Синтез, перетворення та біологічна активність у ряді похідних 1,2,4-триазолу: Дис. …канд. фармац. наук. — К., 2003. — 155 с.
16. Штерн Э., Тиммонс К. Электронная абсорбционная
спектроскопия в органической химии // Методика комплексного спостереження за станом здоров’я кардіологічних
хворих на підставі аналізу психоемоціонального стану. -
М.: Мир, 1974.- 296 с.