Биологические
науки/ Микробиология
К.б.н. Колодязная В.А., к.б.н. Топкова
О.В.
ГОУ ВПО Санкт-Петербургская государственная
химико-фавмацевтическая академия, Россия
Роль продуктов гидролиза крахмала в
биосинтезе ингибитора α-глюкозидаз
– антидиабетического средства гипоглюкина
Сахарный
диабет в наше время приобрел эпидемический характер, являясь одной из наиболее
частых причин инвалидности и смертности. Он входит в первую триаду в структуре
болезней взрослого населения: рак, склероз, диабет. Среди тяжелых хронических
заболеваний у детей сахарный диабет также занимает третье место, уступая пальму
первенства бронхиальной астме и детскому церебральному параличу.
Число
больных диабетом во всем мире составляет 120 млн. (2,5% населения). Каждые
10-15 лет количество больных удваивается. Наиболее тяжелым является
инсулинозависимый диабет (I типа). В действительности число больных в 2-3 раза
больше за счет скрытых недиагностированных форм. В основном, это относится к
диабету II типа, составляющего 85-90 процентов всех случаев диабета [1].
Для
лечения диабета II типа (инсулиннезависимого) предлагается создание новых
препаратов на основе ингибиторов α-глюкозидаз, образуемых
микроорганизмами. В ранее опубликованных работах приведены сведения о новом,
выделенном из почвы, продуценте
ингибитора α-глюкозидаз [2], приведены данные о его структуре, характеристики химического
состава и свойств по сравнению с препаратом "Акарбоза" фирмы Bayer [3].
Продуцентом
нового ингибитора α-глюкозидаз
является Streptomyces sp.
шт. К-20, а препарат
получил название гипоглюкин [4,5]. В данной работе приводятся сведения о
влиянии источников углеводного питания на образование ингибитора в процессе
развития продуцента Streptomyces sp.
Известно, что сведения о биохимических изменениях основных
элементов питательной среды, вовлеченных в метаболизм клетки можно получить,
анализируя изменения в ее составе от момента внесения клетки в среду до
завершения процесса ферментации [6,7]. Используя этот общепринятый метод,
провели исследование динамики потребления углерода в процессе биосинтеза
продуцента ингибитора α-глюкозидаз культурой Streptomyces sp. шт. К-20.
Существует определенная избирательность
любого продуцента биологически активного вещества к углеводу, входящему в
состав питательной среды. Как показали ранее проведенные исследования, из всех
испытанных углеводов продуцент ингибитора α-глюкозидаз лучше всего растет
и накапливает максимальное количество ингибитора на среде, содержащей 2%
растворимого крахмала [8].
На рисунке 1 приведены данные по
утилизации этого углевода культурой (общее содержание редуцирующих веществ РВ),
из которых видно, что в первые часы ферментации углеводы потреблялись из среды
с очень низкой скоростью. Содержание РВ на 3, 6, 12 и 18 часов роста
составляло 19,5; 19,0; 18,0; 16,6 мг/мл, что соответствовало уровню РВ в
исходной среде 19,5±0,5 мг/мл.
2 1 20.0 – 10.0 – 2 1 3 6 9
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
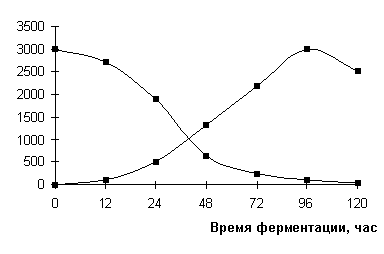
Рисунок 1. Содержание редуцирующих веществ в
культуральной жидкости
Streptomyces sp. шт.К-20.
1 – ингибиторная активность, ИЕ/мл;
2 – содержание редуцирующих веществ, мг/мл.
Такой
медленный темп утилизации РВ сохранялся почти в течение суток ферментации и
только, начиная с 24 часов культивирования продуцента, содержание РВ уменьшалось
до значения 12,8 мг/мл, затем резко
снижаясь до 1,0 мг/мл к 96 часам роста, к моменту максимального синтеза
ингибитора α-глюкозидаз.
В том случае, когда в питательной среде
присутствует сложный углевод, интенсивность его утилизации наглядно
демонстрирует расчет скорости потребления РВ культурой в определенный период
ферментации. Эти показатели были рассчитаны для различных периодов
культивирования продуцента ингибитора α-глюкозидаз и представлены в
рисунке 2.
На
рисунке видно, что интенсивность потребления РВ в период 18-24 часов самая
высокая, она почти в 3 раза выше, чем в начальный интервал времени 3-6 часов и
6-12 часов.
Хорошо
известно, что усвоение продуцентом крахмала происходит вследствие
функционирования выделяемых им в среду амилолитических ферментов,
последовательно расщепляющих макромолекулу крахмала до низкомолекулярных
фрагментов (мальтоолигосахаридов, мальтозы, глюкозы), которые легко усваиваются
клеткой [9.10].
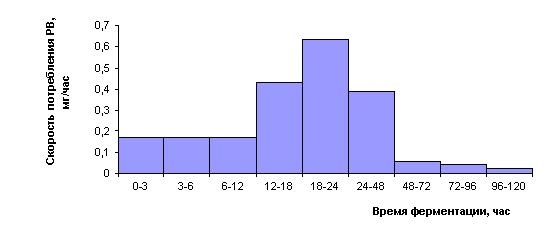
Рисунок 2. Скорость потребления РВ в процессе
ферментации
Streptomyces sp. шт. К-20
Для каждого продуцента для роста и
биосинтеза целевого продукта необходим свой оптимальный состав продуктов
расщепления крахмала, который определяется биологическими особенностями
продуцента и специфичностью действия собственных амилаз культуры.
Проведена оценка содержания внеклеточных
амилаз а процессе культивирования продуцента ингибитора ингибитора
α-глюкозидаз культурой Streptomyces sp. шт. К-20
(рис. 3). Содержание этого фермента определяли в первые часы ферментации с
малым интервалом времени (3, 6, 9 и 12 часов), поскольку именно в этот период
скорость утилизации РВ (т.е. крахмала) была очень низкой.
2 1
1 9 6 3 3000 – 2000 – 1000 – 2
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
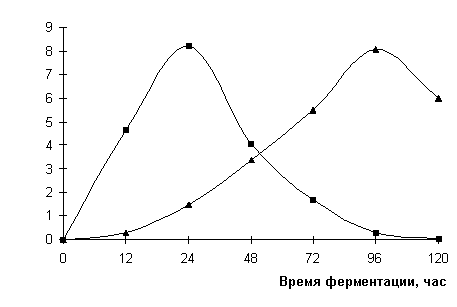
Рисунок 3. Изменение амилолитической активности ферментов
при биосинтезе продуцента ингибитора α-глюкозидаз
1- амилолитическая активность на среде с крахмалом растворимым, АЕ/мл
2- ингибиторная активность, ИЕ/мл
Как
следует из представленных данных, уже с 3-х часов роста продуцента в
крахмалосодержащей среде начиналось накопление амилаз в культуральной жидкости
(0,8 АЕ/мл) и затем их активность резко возрастала до максимально высоких
значений (8,0 АЕ/мл) на 24 часа
ферментации. В этот же период ферментации скорость утилизации РВ была наиболее
высокой (рис. 2). Далее с 24 часов культивирования продуцента происходило
постепенное уменьшение активности амилолитических ферментов, снижаясь до
минимального значения 0,3 АЕ/мл на 96 часов роста, т.е. к моменту полного
исчерпания углеводов из среды (рис. 1). Именно в этот период ферментации
происходит интенсивный синтез ингибитора α-глюкозидаз.
Значительная
активация собственных амилаз у продуцента ингибитора α-глюкозидаз,
особенно в первые часы ферментации, предполагает, что в этот момент происходит
расщепление крахмала до низкомолекулярных фрагментов, активно потребляемых
актиномицетом.
В связи
с этим, представляло интерес провести хроматографический анализ продуктов расщепления крахмала
растворимого, содержащегося в среде, под действием собственных амилаз
продуцента Streptomyces sp. шт. К-20
в течение всего процесса
ферментации.
Тонкослойную хроматографию проводили на готовых
к употреблению пластинках с закрепленным слоем селикагеля Gel 60 F254 фирмы Merck Silica в
системе растворителей изопропанол – этилацетат - вода в соотношении 7:1:2. На
хроматограммы в качестве свидетелей наносили стандартные растворы мальтозы и
глюкозы фирмы «Chalbiochem» в различных концентрациях.
Для обнаружения пятен углеводов пластинку обрабатывали 2% раствором 2,3,5-трифенилтетразолия в спирте.
Идентификацию пятен проводили на сканирующем денситометре, который позволяет подсчитать
площадь пятна, занимаемую соответствующим сахаром (сканирующий спектрофотометр High speed TLC scanner CS-920 фирмы
Shimadzu) при длине волны 490 нм.
Для количественного определения
концентраций сахаров в культуральной жидкости использовали компьютерную
программу Super Calk. При выполнении вычислений использовали стандартную
программу линейной регрессии для персональных компьютеров. Данные представлены
на копии хроматограммы (рис.4) и в таблице
1.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
1 2 3 4 5 6 7 8 9 10 11 12
13 14 15
16 17 18
Рисунок 4. Копия хроматограммы продуктов гидролиза
крахмала растворимого под действием собственных амилаз Streptomyces sp. шт. К-20
1 – исходная ферментационная питательная среда
2,3,4,5,6,7,8,9,10,11 – культуральная жидкость на 3,6,9,12,18,24,30,48,72,96 ч ферментации
12,13,14,15 – стандартные растворы мальтозы в концентрации 2,5; 5,0; 7,5 и 10,0 мкг
16,17,18 - стандартные растворы глюкозы в концентрации 1,0;2,0 и 3,0 мкг
Таблица
1
Содержание мальтозы в культуральной жидкости Streptomyces sp. шт. К-20
|
Время фер-ментации, час |
0 |
3 |
6 |
9 |
12 |
18 |
24 |
48 |
72 |
96 |
|
Количество мальтозы,мг/мл |
0,0116 |
0,0099 |
0,0097 |
0,0096 |
0,0087 |
0,0087 |
0,0087 |
0,0054 |
0,0010 |
0,0003 |
Анализ хроматограм и данных,
представленных в таблице 1, показал,
что в исходной ферментационной среде, содержащей 2% растворимого крахмала,
после ее стерилизации крахмал уже частично гидролизуется. В нем при общем
содержании редуцирующих веществ, равном 19,5±0,5 мг/мл, содержались в основном
декстрины, 0,0116 мг/мл мальтозы (М) и следы глюкозы. Наличие большого
количества декстринов подтверждено качественной реакцией с йодом.
Ярко-фиолетовая окраска раствора свидетельствовала о наличии в нем
амилодекстринов [11].
В первые
часы ферментации (на 3 и 6 часов) в культуральной жидкости также качественной
реакцией определялись декстрины. Доля мальтозы снижалась до 0,0099-0,0097 мг/мл,
глюкоза тоже присутствовала в следовых количествах. Но уже с 9 часов
ферментации на хроматограммах наряду с декстринами и таким же количеством
мальтозы (0,0096 мг/мл), отмечали появление небольших количеств мальтотриозы (М3)
и мальтотетрозы (М4), что соответствовало началу интенсивного
образования амилолитических ферментов (5,0 АЕ/мл). Затем, в последующие часы
ферментации (18-24 часа) в культуральной жидкости отмечали кроме декстринов
наличие этих олигосахаридов (М3 и М4) несколько в большей
концентрации (более интенсивная окраска пятен) и мальтозы в концентрации 0,0087
мг/мл. В этот период культивирования начинался синтез ингибитора
α-глюкозидаз. Начиная с 48 часов культивирования продуцента Streptomyces sp. К-20 в
культуральной жидкости качественной реакцией определялись декстрины, но
мальтоолигосахариды, как видно из хроматограммы, уже отсутствовали. Присутствовала
только мальтоза, количество которой уже уменьшилось до 0,0054 мкг/мл, а затем с
72 часов в культуральной жидкости оставались следовые количества этого углевода.
При
сравнении данных, представленных на рис. 3, можно видеть, что при снижении
активности амилаз в культуральной жидкости происходит и более интенсивное
накопление ингибитора этих ферментов (кривая 2). По-видимому, в этот период ферментации
собственные ингибиторы продуцента тормозят активность собственных
амилолитических ферментов, которые расщепляют крахмал только до тех
олигосахаридов, которые необходимы для синтеза конечного продукта – ингибитора
α-глюкозидаз.
Таким
образом, полученные данные свидетельствуют о том, что собственные амилазы
продуцента ингибитора α-глюкозидаз Streptomyces sp. шт. К-20
проявляли преимущественно свойства α-амилаз, расщепляющих крахмал на большое
количество декстринов, мальтоолигосахариды, мальтозу и следовые количества
глюкозы.
Как
показали проведенные исследования, такое соотношение сахаров в гидролизатах
крахмала, осуществляемое амилазами актиномицета является оптимальным и наиболее
благоприятным для биосинтеза ингибитора α-глюкозидаз культурой Streptomyces sp. шт.
К-20.
Можно
предположить, что мальтоза и мальтоолигосахариды, образующиеся в культуральной
жидкости под воздействием собственных амилаз в процессе выращивания продуцента
ингибитора α-глюкозидаз более доступны микробной клетке, чем другие сахара.
При
изучении транспортных систем углеводов в микробную клетку ряд авторов указывали
на различные энергетические затраты на их фосфорилирование и перенос [12,13].
Показано, что на транспорт молекулы глюкозы затраты энергии составляют до 6
молекул АТФ, а для мальтозы всего 1 молекула АТФ, причем предпочтение при
транспорте углеводов в клетку отдается более длинным цепочкам мальтозы
(мальтотриозам и мальтотетрозам) [14]. Продуцент ингибитора α-глюкозидаз,
образуемый Streptomyces sp. шт.
К-20, выбрал себе тот углевод, который ему легче и проще потреблять.
При этом
нельзя не отметить еще одно обстоятельство. Ранее проведенными исследованиями
показано, что ингибитор α-глюкозидаз, образуемый культурой Streptomyces sp.шт. К-20,
представляет собой псевдоолигосахарид [3,4].
По-видимому, в процессе ферментации
актиномицета мальто-олигосахариды и мальтоза, образующиеся из крахмала под
действием собственных амилаз, не только активно потребляются на рост клетки, но
и участвуют как структурные единицы в синтезе самого ингибитора
α-глюкозидаз.
Литература:
1.
Ефименко А.С. Актуальные
проблемы клинической диабетологии. – Медичний Всесвiт. I.. 2001. №1. С. 14-18.
2.
Колодязная В.А.
Продуцент ингибитора α- глюкозидаз, стабилизация его ингибиторной
активности и изучение условий биосинтеза: Автореф. дис. на соиск. учен. ст.
к.б.н.: 03.00.23. СПб.: СПХФА, 2006. –
23 с.
3.
Акулова
Н.Ю. Ингибиторы α-глюкозидаз из Streptomyces. Выделение и свойства:
Автореф. дис. на соиск. учен. ст. канд. биол. наук: 03.00.04. СПб.: СПХФИ, 1993. – 20 с.
4.
Селезнева
А.А., Акулова Н.Ю. Ингибиторы α-глюкозидаз микробного происхождения. // Биол.
науки. - 1992, т. 2, С. 25-31.
5.
Акулова Н.Ю., Селезнева А.А.
Микробные ингибиторы α-глюкозидаз псевдосахаридной природы (обзор). // Приклад.
биохим. и микробиол. - 1995. т. 31, №4, С. 371-380.
6.
Промышленная
микробиология: Под ред. Н.С. Егорова. – М.: Высшая школа, 1989. – 688 с.
7.
Елинов Н.П. Основы
биотехнологии. С-Пб.: Наука, 1995. - 600 с.
8.
Колодязная В.А. Влияние
источников углеводного питания на биосинтез гипоглюкина – нового
антидиабетического средства.// Тез. докл. X Росс. науч. конгр. "Человек и
лекарство", М., 2003. С. 574.
9.
Егоров Н.С. Основы
учения об антибиотиках. М.: МГУ, 1994. – 512 с.
10.
Meneses F., Henschke
P., Jiranek V. A survey of industrial strains of Saccharomyces
cerevisiae reveals numerous alttems of maltose and sucrose utilization. // J.
Inst. Brew. 2002. Vol. 108, №3. P.
310-321.
11.
Алейников Т.Л., Рубцова
Г.В.. Биохимия. Руководство к практическим занятиям по биологической химии. М.: Высшая школа, 1988. – 240 с.
12. Dills S., Apperson
A., Schmidt M. and Saler J. Carbohydrate transport in bacteria. //Microbiol.
Rev. 1980. Vol. 44. P. 385-418.
13. Henderson P. The
inter-relationship between protocoupled and binding protein-dependent transport
system in bacteria. //Biochem. Soc. Trans. – 1980. - Vol. 8. – P. 677-679.
14. Muir M., Williams
L. and Ferenci T. Influence of Transport Energization on the Growth of
Escherichia coli. //American Sosiety for Microbiology. 1985. Vol. 163. P.
1237-1242.