Химия и химические технологии / 5. Фундаментальные проблемы создания новых материалов и технологий
*Смирнова
Е.В., *Цыба Ю.В., *Бондарев Н.В., **Зайцева
И.С.
*Национальный
университет имени В.Н. Каразина, Харьков, Украина
**Харьковская
национальная академия городского хозяйства, Украина
Регрессионный анализ
влияния свойств
водно-диметилсульфоксидных
растворителей на силу
уксусной и бензойной кислот
Химические корреляции семейства S(x)i = f×[P(x)i] (где S(x)i – свойство; P(x)i – эмпирический параметр),
первыми из которых были уравнения Бренстеда и Гаммета, породили новую
внетермодинамическую концепцию физической химии – линейность энергий и свободных
энергий, наиболее распространенную в приложении к энергии Гиббса.
Для нахождения уравнения множественной регрессии
необходимо, чтобы выполнялась важнейшая предпосылка множественного анализа –
дескрипторы x (свойства смешанных
растворителей) не должны быть мультиколлинеарными, т.е. линейно связанными.
Регрессионный анализ [1,2] зависимости энергии Гиббса диссоциации
(∆dG(Csm), кДж/моль) уксусной и
бензойной кислот от донорно-акцепторных (ETN – нормализованный параметр Димрота-Райхардта,
BKT
– нормализованный параметр Камлета-Тафта) и диэлектрических (1/eN, eN –
нормализованная диэлектрическая проницаемость) свойств водно-диметилсульфоксидных растворителей (табл. 1)
заключался в проверке коллинеарности дескрипторов (корреляционный анализ, табл.
2 в качестве примера); оценке параметров регрессионной зависимости (табл. 3,4);
оценке стандартной ошибки s коэффициентов
регрессии; проверке нулевой гипотезы о значимости уравнения регрессии по F-критерию (критерий Фишера); проверке
нулевой гипотезы о значимости коэффициентов регрессии по t-критерию (критерий Стьюдента); оценке адекватности регрессионной
модели на основе анализа остатков.
Таблица
1. Стандартные энергии Гиббса диссоциации ∆dGо(Csm) кислот, значения параметров
Димрота-Райхардта (ETN),
Камлета-Тафта (BKT ) и обратной величиной диэлектрической
проницаемости водно-диметилсульфоксидных растворителей при 298.15 К
|
|
мол. д. ДМСО |
∆dGо(Csm)* С6Н5СООН |
∆dGо(Csm) СН3СООН |
1/eN |
ETN |
BKT |
|
1 |
0 |
23,98 |
27,17 |
1,000 |
1,00 |
0,19 |
|
2 |
0,05 |
25,46 |
28,49 |
1,011 |
0,92 |
0,28 |
|
3 |
0,1 |
26,88 |
30,06 |
1,024 |
0,85 |
0,35 |
|
4 |
0,2 |
29,66 |
33,91 |
1,056 |
0,75 |
0,44 |
|
5 |
0,3 |
32,55 |
38,72 |
1,098 |
0,68 |
0,51 |
|
6 |
0,4 |
35,76 |
44,49 |
1,150 |
0,63 |
0,56 |
|
7 |
0,5 |
39,5 |
51,22 |
1,211 |
0,59 |
0,61 |
∆dGо(Csm)* – в аквамоляльной концентрационной шкале
Таблица 2. Парные коэффициенты корреляции между энергией
Гиббса диссоциации ∆dGо(Csm) бензойной кислоты, параметрами Димрота-Райхардта (ETN),
Камлета-Тафта (BKT) и обратной величиной диэлектрической проницаемости
водно-диметилсульфоксидных растворителей при 298.15 К
|
|
∆dGо(Csm) |
1/eN |
ETN |
BKT |
|
∆dGо(Csm) |
1,00 |
0,99 |
–1,0 |
1,0 |
|
1/eN |
0,99 |
1,00 |
–0,9 |
0,9 |
|
ETN |
–0,97 |
–0,93 |
1,0 |
–1,0 |
|
BKT |
0,96 |
0,93 |
–1,0 |
1,0 |
Таблица
3. Значения B, Std.Err.,
t(4), p-level для энергии Гиббса диссоциации бензойной кислоты
|
n =7 |
B |
Std.Err. |
t(4) |
p-level |
|
Intercept |
–16,2853 |
0,867245 |
–18,7782 |
0,000047 |
|
1/eNVar30 |
51,4657 |
0,595149 |
86,4753 |
0,000000 |
|
ETNVar31 |
–11,1910 |
0,305315 |
–36,6539 |
0,000003 |
Таблица
4. Значения B, Std.Err.,
t(4), p-level для энергии Гиббса диссоциации уксусной кислоты
|
n =7 |
B |
Std.Err. |
t(4) |
p-level |
|
Intercept |
–79,4312 |
1,197016 |
–66,3577 |
0,000000 |
|
1/eNVar4 |
109,2089 |
0,822791 |
132,7298 |
0,000000 |
|
ETNVar5 |
–2,6638 |
0,421124 |
–6,3254 |
0,003197 |
Таким образом, влияние диэлектрических и
электроноакцепторных эффектов смешанных водно-диметилсульфоксидных
растворителей на силу кислот описывается уравнениями регрессии
∆dGо(СН3СООН,
Csm) = (–79.4 ± 3.3) + (109.2 ± 2.3)eN-1
– (2.7 ± 1.2)ETN,
n =7; s = 0.06; F(2,4) = 71593, Fкр(2,4) =6.94; r = 0.9999;
∆dGо(С6Н5СООН,
Csm) = (–16.3 ± 2.4) + (51.5 ± 1.6)eN-1–(11.19
± 0.85)ETN,
n =7; s = 0.04; F(2,4)=58367, Fкр(2,4) =6.94; r
= 0.9999,
где
n – число экспериментальных
точек; s – стандартная ошибка
аппроксимации; Fкр – критический коэффициент Фишера; r – коэффициент корреляции.
Уменьшение
силы исследованных карбоновых кислот (рисунок) обусловлено кулоновским
межионным взаимодействием (∆∆Gd(eN-1) > 0) и
преобладанием стабилизации недиссоциированных молекул кислоты над стабилизацией
ионов под воздействием электроноакцепторных эффектов водно-диметилсульфоксидных
растворителей (∆∆Gd(ETN) > 0).
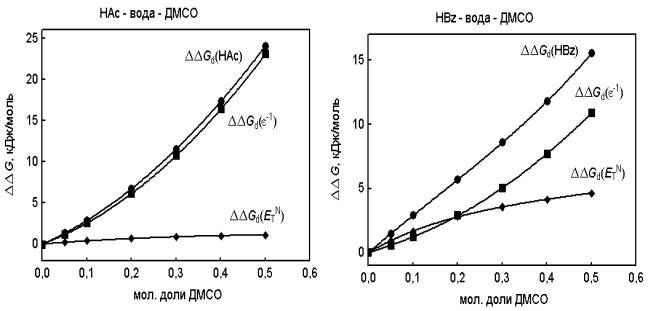
Рисунок.
Влияние электроноакцепторных ∆∆Gd(ETN) и
диэлектрических ∆∆Gd(eN-1) свойств смешанных растворителей
вода-диметилсульфоксид на уменьшение силы уксусной и бензойной кислот
∆∆Gd.
1.
Зайцева И.С., Ельцов
С.В., Кабакова Е.Н., Бондарев Н.В. // Журнал
общей химии. –2003. Т.73, Вып. 7. –С. 1079-1084.
2.
Tsurko E.N., Bondarev
N.V. // J. Mol. Liquids. –2007. № 131-132. – P.151-157.