Химия/4. Химико-фармацевтическое производство
Щёлок Владимир Сергеевич
НАЦИОНАЛЬНЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
«ХАРЬКОВСКИЙ ПОЛИТЕХНИЧЕСКИЙ ИНСТИТУТ»
Оптимизация условий
проведения ковалентной иммобилизации амилаз на кремнеземные носители
Объектом исследования являются биотехнологические процессы получения иммобилизованных ферментов.
Проблемой было получение стабильного иммобилизованного фермента, который мог бы
сохранять активность на довольно длительном
промежутке времени. Целью работы была оптимизация условий получения
иммобилизованных ферментов. Получение
иммобилизованых ферментов связано с необходимостью жесткого
связывания фермента с матрицей (носителем). На сегодня предложено довольно много способов
иммобилизации ферментов, однако каждый из них имеет достоинства и недостатки.
Нами выбран химический метод иммобилизации с помощью
сшивающего
агента. Этот метод имеет ряд преимуществ [1,2] по
сравнению с
физической иммобилизацией.
Стадии
иммобилизации: 1) высушивание носителя; 2) аминирование γ-АПТЭСом
(γ-аминопропилтриэтоксисилан) носителя; 3) реакция со сшивающим агентом –
глутаровым альдегидом; 4) присоединение фермента – амилазы к активированному
носителю.
1) Размалываем
носитель и отбираем фракцию 0,25 мм < d < 0,5 мм. Сушим носитель в
муфельной печи.
2) Смешиваем
размолотый силикагель и 5 % раствор γ-АПТЭС в стакане на 100 см3 и
выдерживаем 30 минут при комнатной температуре. Раствор покрывает носитель.
Декантацией получаем порошок.
Проводим
определение оптимальных параметров аминации носителя.
Проверяем
количество аминогруп по методике[2].
Определение оптимальной температуры высушивания силикагеля
на стадии аминации. Был выбран диапазон температур, по которому велось
высушивание:
Т1= 80 0C
→ n(NH2) = 0,375 ммоль/г; Т2= 90 0C
→ n(NH2) = 0,4138 ммоль/г;
Т3= 100 0C
→ n(NH2) = 0,435 ммоль/г; Т4= 110 0C
→ n(NH2) = 0,425 ммоль/г;
Т5= 120 0C
→ n(NH2) = 0,4138 ммоль/г.
Видим, что оптимальной температурой проведения стадии
аминации является Т = 100 °C.
Определение оптимального времени высушивания силикагеля на
стадии аминации. Был выбран диапазон промежутков времени:
τ1= 80 мин
→ n(NH2) = 0,401 ммоль/г; τ2 = 90 мин →
n(NH2) = 0,425 ммоль/г;
τ3 = 100 мин
→ n(NH2) = 0,435 ммоль/г; τ4 = 110 мин →
n(NH2) = 0,4138 ммоль/г; τ5 = 120 мин → n(NH2)
= 0,401 ммоль/г.
Промываем
порошок 20-ти кратным объемом дистиллированной воды по отношению к объему
образца. После повторной декантации сушим порошок при 120 °С в муфельной печи 1
час.
Проводим контрольный
опыт – все стадии аминации, но без добавления γ-АПТЭС.
Также по вышеописанной методике было проведено первую и
вторую стадию для боро-силикатного и натрий-кальциевого стекла. Были получены
следующие результаты.
Стекло боро-силикатное – определение оптимальной температуры
сушения стекла на стадии аминации:
Т1= 80 0C
→ n(NH2) = 0,0811 ммоль/г; Т2= 90 0C
→ n(NH2) = 0,0878 ммоль/г;
Т3= 100 0C
→ n(NH2) = 0,0872 ммоль/г; Т4= 110 0C
→ n(NH2) = 0,0878 ммоль/г; Т5= 120 0C
→ n(NH2) = 0,0797 ммоль/г.
Стекло натрий-кальциевое – определение оптимальной
температуры высушивания стекла на стадии аминации:
Т1= 80 0C
→ n(NH2) = 0,0188 ммоль/г; Т2= 90 0C
→ n(NH2) = 0,0188 ммоль/г;
Т3= 100 0C
→ n(NH2) = 0,0106 ммоль/г; Т4= 110 0C
→ n(NH2) = 0,0123 ммоль/г; Т5= 120 0C
→ n(NH2) = 0,0156 ммоль/г.
Стекло боро-силикатное – определение оптимальной
продолжительности высушивания стекла на стадии аминации:
τ1= 80 мин
→ n(NH2) = 0,0797 ммоль/г; τ2 = 90 мин →
n(NH2) = 0,0872 ммоль/г; τ3 = 100 мин → n(NH2)
= 0,0811 ммоль/г; τ4 = 110 мин → n(NH2) =
0,0878 ммоль/г; τ5 = 120 мин → n(NH2) = 0,0854
ммоль/г.
Стекло натрий-кальциевое – определение оптимальной
продолжительности высушивания стекла на стадии аминации:
τ1= 80 мин
→ n(NH2) = 0,0123 ммоль/г; τ2 = 90 мин →
n(NH2) = 0,0188 ммоль/г; τ3 = 100 мин → n(NH2)
= 0,0179 ммоль/г; τ4 = 110 мин → n(NH2) =
0,0156 ммоль/г; τ5 = 120 мин → n(NH2) = 0,0179
ммоль/г.
3) На аналитических весах взвешиваем 1 г аминосиликагеля,
засыпаем силикагель в стакан на 100 см3 и прибавляем 2,5 см3
2,5 % раствора глутарового альдегида. [3] Выдерживаем раствор с порошком при Т
= 22 °С 20 часов.
4) Промываем сорбент (силикагель) дистиллированной водой.
Обрабатываем активированный носитель водным раствором амилаз
– 5
см3 раствора с концентрацией белка 10 г/дм3. Выдерживаем
24 часа при комнатной температуре.
Промываем
иммобилизованный фермент дистиллированной водой для удаления несвязанного
белка.
Обрабатываем
иммобилизованный фермент 0,1 % раствором NaBH4 –
30 минут при комнатной температуре.
Проверка
активности фермента (зависимость активности иммобилизованного фермента от
количества проведенных подряд смен работы) проводилась на магнитном смесителе:
к 5 см3 1 % раствора крахмала прибавляли каплю йода (наблюдалась
синяя окраска раствора) и 1 г иммобилизованного фермента – засекали время до
полного исчезновения окраски раствора. Активность (г/мин) определяли по
формуле:
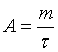
где m – масса гидролизированного крахмала,
τ
– время полного обесцвечивания раствора.
Были
полученные такие результаты за 8 смен беспрерывной работы фермента: τ1
= 323 с; τ2 = 660 с; τ3 = 347 с; τ4
= 370 с; τ5 = 375 с; τ6 = 508 с; τ7
= 769 с; τ8 = 2000 с.
В работе были определены оптимальные температура выдержки носителя
и продолжительность высушивания на стадии аминации при получении
иммобилизованного фермента. Также было выяснено, что наблюдается некоторая
потеря активности иммобилизованного фермента при беспрерывной работе на
протяжении 5-8 изменений работы. Также было выяснено, что иммобилизованный
фермент сохраняет свою активность на протяжении не менее 3-х месяцев. В
перспективе – использование и усовершенствование метода получения
иммобилизованных ферментов для гетерогенного ферментативного гидролиза смесей,
которые содержат крахмал или декстрины.
Список литературы:
1. Коликов В.Μ., Μчедлишвили
Б.В. Хроматография биополимеров на макропористых кремнеземах. – Л.: Наука,
1986. – 190 с.;
2. Ворошилова О.И., Киселев А.В., Никитин
Ю.С. Синтез и исследование кремнеземных носителей с поверхностью,
модифицированной γ-аминопропильными группами// Коллоидный журнал- М.:
Химия. – 1990. – № 2. С. 223 – 229.;
3. Патент С 12 № 11/14 Cпособ получения
иммобилизованных протеолитических ферментов /
А.В. Брыкалов, В.И. Ковальков,
В.П. Требуха, С.И. Кольцов. 1084300 / SU. Заявлено
27.08.82. Опубл. 07.04.84. Бюл. № 13.