Технические науки/ Металлургия
К.т.н. Дзюба
О.И., ОАО «Завод КОНСТАР», Селикова М.В. , КИ КУЭИНТУ
Изучение
возможности регенерация промывных вод в процессе обескремнивания
марганецсодержащего концентрата
В процессе автоклавного выщелачивания марганцевых концентратов при их химическом обогащении происходит накопление промывных вод, главным образом, состоящих из кремнезема в виде силиката натрия. Для повторного использования выщелачивающих растворов необходима их очистка от вредных составляющих - Na+; OH-; SiO32-.
С целью решения данной проблемы были проведены исследования по регенерации, утилизации промывных вод и определены максимально допустимые концентрации примесных ионов в циркулирующем растворе.
Для очистки растворов, полученных после выщелачивания, был использован метод электродиализа.
В последние годы метод электродиализа широко применяется для решения следующих задач: а) концентрирование морской воды с целью выделения при помощи последующей упарки растворимых солей; б) производство чистого каустика; в) утилизация серной кислоты из обработанных травительных растворов и др.
В задачу настоящих исследований входило: 1) определение условий, обеспечивающих регенерацию щелочи методом электродиализа из растворов после обескремнивания марганецсодержащих концентратов; 2) подбор материала электродов и определение оптимальной плотности тока; 3) определение выхода по току в зависимости от концентрации щелочи в анолите, католите и содержания оксида кремния в исходном растворе; 4) определение расхода электроэнергии на регенерацию щелочи.
Метод очистки растворов электродиализом можно охарактеризовать как избирательный перенос ионов через полупроницаемую мембрану под действием электрического тока. При электродиализе происходят те же химические реакции, что и при электролизе. Применение полупроницаемой мембраны изменяет течение основного процесса электролиза, вводя новые факторы, каковыми являются изменение чисел переноса в порах мембран по сравнению с объемом электролита и электростатический перенос жидкости через диафрагму. Природа диафрагмы оказывает существенное влияние на ход электролиза, причем большое значение имеет знак ее заряда. Химические превращение при электролизе могут быть различными в зависимости от вида электролита, материала электродов и присутствия других веществ в растворе.
Электродиализ растворов с избыточной содой или щелочью, осуществляемый в двухкамерной электродиализной ванне с диафрагмой по электрохимическим процессам, проходящим на электродах, аналогичен электролизу воды в щелочной среде. Однако, ввиду различного химического состава аналиты и католиты в анодном и катодном пространствах протекают химические взаимодействия, присущие только данному процессу.
При прохождении электрического тока ионы натрия будут мигрировать в катодное пространство, а гидроксильные ионы разряжаться по реакции:
2ОН- - 2е ® Н2О + 0,5О2
Образующаяся в результате гидролиза угольная кислота вследствие неустойчивости в анолите будет разлагаться и выделяться из раствора в виде углекислого газа. На аноде будет выделяться кислород.
В катодном пространстве ионы натрия, перешедшие из анолита, не могут разряжаться на катоде в водных растворах, вследствие высокого отрицательного электродного потенциала, поэтому на катоде происходит разряд молекулы воды с выделением газообразного водорода по реакции:
Н2О + е → ОН- + 0,5Н2
в результате чего в катодном пространстве происходит накапливание ионов натрия, образующих едкую щелочь.
Исследования по электродиализу растворов проводили с использованием двухкамерного электродиализатора с применением ионитовой мембраны МК-40. Схема установки приведена на рис. 1. В качестве катода была принята нержавеющая сталь Х18Н9Т, т.к. при данных условиях водород на этом катоде выделяется со сравнительно низким перенапряжением. В качестве анода испытывался следующий материал: нержавеющая сталь, графит, титан, никель.
Аноды из нержавеющей стали и графита активно окислялись даже при низкой плотности тока. Применение анода из титана вызывало резкое повышение напряжения на ванне до 100 вольт вследствие его пассивации.
Наиболее положительные результаты получены с никелевыми анодами, на которых кислород выделяется с меньшим перенапряжением, и они не подвергались коррозии при анодной плотности тока ниже 75 мА/см2.
Напряжение на ванне при электродиализе раствора, полученного после автоклавного выщелачивания, составляло 4-5 вольт. При более высокой анодной плотности тока наблюдается значительная коррозия и повышения напряжения на ванне.
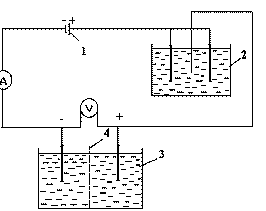
Рис.1 Схема электродиализной установки: 1 - источник постоянного тока; 2 - кулонометр; 3 - электродиализная ванна; 4 - катионитовая мембрана
Влияние содержания SiO2 в щелочном растворе на процесс электродиализа и изменение концентраций щелочи в анолите и католите на выход по току изучался на синтетических растворах.
Исходным аналитом служит раствор NaOH 100 г/дм3, концентрация NaOH в католите 5 г/дм3. В анолит добавлялось жидкое стекло до содержания SiO2 в растворе 15; 20; 25; 40; 50; 60 г/дм3.
По перешедшему в катодное пространство количеству натрия и пропущенному количеству электричества определялся выход по току. По мере увеличения концентрации щелочи в католите соответственно уменьшилось ее содержание в анолите.
С повышением содержания кремнезема в анолите выход по току уменьшается, но во всех случаях при исследуемых концентрациях остается на довольно высоком уровне (80-93%) в начале процесса. При достижении концентрации щелочи в католите выше 60 г/дм3 резко снижается выход по току. Уменьшение концентрации NaOH и относительное увеличение содержания оксида кремния в растворе приводит к образованию пленки кремниевой кислоты на аноде, его пассивированию, увеличению напряжения на ванне и в дальнейшем к коррозии анода. В проведенных лабораторных исследованиях показана возможность получения чистого раствора щелочи с концентрацией 100-120 г/дм3 методом электродиализа. Кремниевая кислота при этом полностью концентрируется в анолите. Однако, вследствие понижения концентрации щелочи в анолите и большого содержания кремниевой кислоты в растворе перевести полностью щелочь в катодное пространство не представляется возможным. Любое содержание кремниевой кислоты в растворе вызывает явление, расстраивающее процесс электролиза, повышение напряжения и плотности тока на аноде, приводящие к высокому расходу электроэнергии и низкому извлечению щелочи.
Указанные причины дают основание считать, что метод электродиализа для регенерации щелочи из растворов после выщелачивания кремнезема из марганецсодержащих концентратов является мало эффективным и энергоемким.