Биричевская
Л.Л.1, Хайкина Д.Б.3, Квач С.В.1, Ерошевская
Л.А.1,
Кисель М.А.2,
Николаевич В.А.2, Зинченко А.И.1
1Институт
микробиологии НАН Беларуси, Минск, Беларусь
2Институт
биоорганической химии НАН Беларуси, Минск
3Международный
государственный экологический университет
им. А.Д.
Сахарова, Минск
Синтез 5' фосфатидилрибавирина
с использованием микробной фосфолипазы D
Противовирусные и противоопухолевые
препараты на основе модифицированных нуклеозидов имеют ряд недостатков. Прежде
всего, в некоторых клетках-мишенях отсутствуют киназы, способные инициировать
метаболическую активацию таких нуклеозидов. Далее, многие нуклеозиды плохо
проникают в клетки и поэтому большая часть их выводится из организма в
неизмененном виде. Отсюда, поиск препаратов, способных с большей эффективностью
проходить сквозь клеточную мембрану, является актуальной задачей. Одним из
простых и эффективных подходов к решению проблемы транспорта водорастворимых
субстанций через гидрофобные липидные биологические мембраны в клетку является
химическая модификация нуклеозидов остатками жирных кислот или фосфолипидами [1–4].
Такие коньюгаты содержат фосфатидный остаток в качестве
нетоксичной транспортной группы, которая защищает нуклеозид от разложения
ферментами и, обладая высокой аффинностью к клеточным мембранам, облегчает
проникновение лекарства в пораженные клетки. В клетках происходит постепенное
освобождение нуклеозида, причем в ряде случаев уже в 5′-монофосфорилированной
форме, что укорачивает цепь трансформации нуклеозида в истинное действующее
начало – нуклеозид-5′-трифосфат. Последнее обстоятельство имеет решающее
значение для тех систем, где отсутствует соответствующая нуклеозидкиназа.
Нам представлялось целесообразным для
получения фосфолипидных аналогов нуклеозидов использовать не трудоемкие
многостадийные химические способы, а предложенный японскими исследователями
ферментативный подход, который заключается в переносе фосфатидного остатка с
лецитина на первичные спирты под действием микробной фосфолипазы D [5–7]
(рисунок 1).
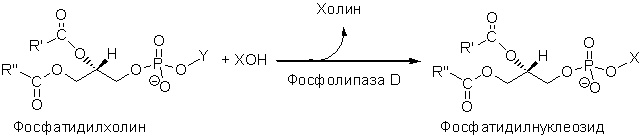
Рисунок 1. –
Реакция трансфосфатидилирования нуклеозидов, катализируемая фосфолипазой D
R′, R′′ – алкилы; Х – остаток нуклеозида; Y – остаток холина
 С этой целью, ранее нами был отобран штамм Streptomyces netropsis
БИМ В-235, продуцирующий внеклеточную фосфолипазу D, и продемонстрирована принципиальная возможность
переноса с его помощью фосфатидного остатка с яичного лецитина на рибавирин (1-ß-D-рибофуранозил-1,2,4-триазол-3-карбоксамид) [8]. Настоящая работа является продолжением этого
исследования и посвящена препаративному синтезу 5′-фосфатидильного производного рибавирина (рисунок
2) с помощью фосфолипазы D нового, более активного продуцента этого фермента [9].
С этой целью, ранее нами был отобран штамм Streptomyces netropsis
БИМ В-235, продуцирующий внеклеточную фосфолипазу D, и продемонстрирована принципиальная возможность
переноса с его помощью фосфатидного остатка с яичного лецитина на рибавирин (1-ß-D-рибофуранозил-1,2,4-триазол-3-карбоксамид) [8]. Настоящая работа является продолжением этого
исследования и посвящена препаративному синтезу 5′-фосфатидильного производного рибавирина (рисунок
2) с помощью фосфолипазы D нового, более активного продуцента этого фермента [9].
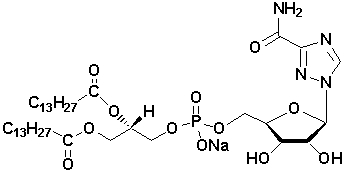
Рисунок 2 – Структурная формула
5′-фосфатидилрибавирина
Культивирование Streptomyces netropsis БИМ В-428Д (далее S. netropsis),
хранящегося в Белорусской коллекции непатогенных микроорганизмов Института
микробиологии НАН Беларуси, и получение препарата фосфолипазы D проводили, как
описано нами ранее [10]. Трансферазную активность
фосфолипазы D определяли в реакции переноса
фосфатидного остатка с молекулы фосфатидилхолина
(лецитина) на 5′-гидроксильную группу тимидина путем инкубирования при 37оС
в течение 45 мин реакционной смеси (1 мл), состоящей из 67% хлороформа и 33% водной
фазы и содержащей 10 мМ тимидин, 30 мМ лецитин, 0,1 М Na-ацетатный буфер (рН
6,0), 0,25 М CaCl2 и 0,2 мл препарата, содержащего фермент. За ходом
реакции следили, используя тонкослойную хроматографию (ТСХ) на пластинах
Silufol-UV254 («Serva»,
Германия) в системе растворителей хлороформ–метанол–25%-ный аммиак (14:4:0,15; v/v). Вещества обнаруживали в УФ-свете и элюировали: нуклеозид
дистиллированной водой, а фосфолипидное производное – этанолом.
Активность фосфолипазы D определяли за
время, при котором выход продуктов не превышал 15–20%.
За единицу активности фермента принимали такое его количество, которое
обеспечивало трансформацию субстрата или образование продукта в количестве 1
нмоль за 1 мин протекания реакции.
Использованный в работе
рибавирин синтезировали методом ферментативного трансгликозилирования, как было
описано нами ранее [11]. Спектры поглощения записывали на
регистрирующем спектрофотометре UV-1202 фирмы «Shimadzu» (Япония).
Проведенные эксперименты по оптимизации
условий реакции трансфосфатидилирования позволили предложить следующую методику
препаративного получения 5´-фосфатидил-1-ß-D-рибофуранозил-1,2,4-триазол-3-карбоксамида.
Реакционную смесь (60 мл),
содержащую 878 мг (3,6 ммоль) рибавирина, 40 мл хлороформа, 7,9 мл 0,5 М Na-ацетатного буфера (рН 6,0), 960 мг (1,2
ммоль) фосфатидилхолина (соевый лецитин Epicuron-200 фирмы Lucas Meyer; Германия), 1 мл 2,0 М CaCl2 и 11 мл фильтрата КЖ (содержащего 1,5 тыс. ед./мл фосфолипазы D), перемешивали при 37оС в
течение 3 ч. Затем к реакционной смеси добавляли 20 мл насыщенного раствора NaCl и 40 мл метанола, слои разделяли
центрифугированием (3000 g, 5 мин), отбирали нижний хлороформно-метанольный слой, и
растворитель упаривали под вакуумом. Остаток растворяли в 15 мл хлороформа и
очищали флеш-хроматографией на силикагеле (размер частиц 5–40 мкм), применяя
ступенчатый градиент растворителей хлороформ-метанол от 19:1 до 2:1 (по объему).
Фракции, содержащие по данным ТСХ чистый 5´-фосфатидилрибавирин, собирали и растворитель упаривали.
Выход целевого продукта 290 мг (30%). Структура целевого продукта доказана на основании
анализа данных ТСХ, УФ- и 1Н-ЯМР-спетроскопии.
Таким образом, в настоящей работе
экспериментально обоснована возможность использования препарата фосфолипазы D нового
штамма-продуцента S. netropsis БИМ В-428Д для препаративного
синтеза коньюгата фосфолипида с противовирусным нуклеозидом – рибавирином.
Имеются основания полагать, что такая депонированная форма рибавирина будет
способствовать его стабильности в русле крови и повышению адресности доставки в
клетки-мишени.
Литература:
1. Ryu E.K., Ross R.J., Matsushita T., MacCoss M.,
Hong C.I., West C.R. Phospholipid-nucleoside conjugates. 3. Syntheses and preliminary
biological evaluation of 1-b-D-arabinofuranosylcytosine 5′-monophosphate-L-1,2-dipalmitin
and selected 1-b-D-arabinofuranosylcytosine 5′-diphosphate-L-1,2-diacylglycerols
// J. Med. Chem. –
1982. – Vol. 25, N 11. – P. 1322–1329.
2.
Водовозова Е.Л., Павлова Ю.Б., Полушкина М.А.,
Ржанинова А.А., Гараев М.М., Молотковский Ю.Л. Новые фосфолипиды – ингиторы
репродукции вируса иммунодефицита человека. Синтез и антивирусная активность //
Биоорг. хим. – 1996. – Т. 22, № 6. – С. 451–457.
3.
Малекин С.И., Кругляк Ю.Л., Хромова Н.Ю. и др.
Новые конъюгаты нуклеозидов с фосфолипидами. Синтез и анти-ВИЧ-активность rac-1-гексадецил-2-ацил-sn-глицеро-3-фосфонуклеозидов // Биорг. хим. – 1997. –
Т. 23, № 8. – С. 648–654.
4.
Швец В.И., Каплун А.П., Юркевич А.М. Создание
нового поколения лекарственных и биохимических препаратов, использующих
пассивный и активный мембранный и липосомальный транспорт // Тез. докл. XVI Менделеевского съезда по общей и прикладной химии. –
Санкт-Петербург, 1998. – С. 166–167.
5. Shuto S., Ueda S., Immamura
S., Fukukawa K., Matsuda A., Ueda T. A facile one-step synthesis of 5′-phosphatidylnucleosides
by an enzymatic two-phase reaction // Tetradron Lett. – 1987. – Vol. 28, N 2. –
P. 199–202.
6. Shuto S., Imamura S., Fukukawa K., Ueda T. Phospholipase
D-catalyzed trans-alkylphosphorylation: a facile one-step synthesis of
nucleoside 5′-alkylphospfates // Chem. Pharm. Bull. – 1988. – Vol. 36, N
12. – P. 5020–5023.
7. Shuto S., Itoh H., Sakai A., Imamura S., Matsuda A.
Nucleosides and nucleotides. CXXXVII. Antitumor phospholipids with
5-fluorouridine as a cytotoxic polarhead: synthesis of 5′-phosphatidyl-5-fluorouridines
by phospholipase D-catalyzed transphosphatidylation // Bioorg. Med. Chem. – 1995.
– Vol. 3, N 3. – P. 235–243.
8.
Биричевская Л.Л., Ерошевская Л.А., Кисель М.А., Зинченко А.И. Использование
фосфолипазы D нового микробного штамма-продуцента для синтеза фосфолипидных
производных модифицированных нуклеозидов // Доклады НАН Беларуси. – 2006. – Т.
50, № 4. – С. 68–71.
9. Штамм бактерий Streptomyces netropsis, продуцирующий
фосфолипазу D: пат. 11915 Респ. Беларусь, МПК7
С 12N 1/20 / Л.Л. Биричевская, Л.А. Ерошевская, А.И. Зинченко.
№ а 20071025; заявл. 15.08.07; опубл. 30.04.09.
10. Барай В.Н., Фещенко Л.Л., Демчук Е.И., Зинченко А.И. Разработка метода очистки фосфолипазы D Streptomyces
netropsis // Микробиология и биотехнология ХХI столетия: матер. Международ. конф. – Мн., 2002.– С. 169–170.
11. Barai V.N., Zinchenko A.I.,
Eroshevskaya L.A., Kalinichenko E.N., Kulak T.I., Mikhailopulo I.A. An
universal biocatalyst for the preparation of base- and sugar-modified
nucleosides via an enzymatic
transglycosylation / // Helvetica Chim. Acta. – 2002. – Vol. 85,
N 7. – Р. 1901–1908.