Бурко Д.В., Квач С.В., Ерошевская Л.А., Зинченко
А.И.
Институт микробиологии НАН Беларуси, г.
Минск
Конструирование рекомбинантного
штамма Escherichia coli,
продуцирующего гомологичную неорганическую
пирофосфатазу
Как известно,
реакция ферментативного синтеза фармакологически важного диаденозинтетрафосфата
(Ар4А) [1] представляет собой двухстадийный процесс [2]. На первой стадии реакции лизил-тРНК-синтетаза
из лизина и AТP образует комплекс фермента с аминоациладенилатом,
высвобождая побочный продукт – пирофосфат. На второй стадии реакции комплекс
фермента с аминоациладенилатом атакуется второй молекулой АТР, в результате
чего образуется Ар4А и освобождаются исходная аминокислота и
фермент. Данная реакция является обратимой, и сдвиг равновесия в сторону образования
конечного продукта зависит от наличия в реакционной среде пирофосфата, поэтому необходимым
является его расщепление до ортофосфата с помощью фермента – неорганической
пирофосфатазы, дополнительно вводимой в реакционную смесь.
Неорганическая пирофосфатаза
(КФ 3.6.1.1) является дорогостоящим коммерческим продуктом. В связи с этим, нами
была предпринята попытка создать рекомбинантный штамм-продуцент этого фермента,
получить высокоочищенный препарат неорганической пирофосфатазы и изучить
возможность применения его для синтеза Ар4А в качестве
дополнительного фермента, способного влиять на сдвиг равновесия реакция в
сторону образования целевого продукта.
Для настоящего
исследования нами была выбрана рЕТ-система-экспрессии. В качестве вектора
использовали плазмиду рЕТ24b+, а в качестве штамма-реципиента – E. coli BL21(DE3). Ген ppa, кодирующий
пирофосфатазу, был выделен методом ПЦР с использованием в качестве матрицы
геномной ДНК штамма E.
coli DH5α. Подбор праймеров для ПЦР проводился с
использованием программного обеспечения Vector NTI 9.0 на основе последовательностей гена
неорганической пирофосфатазы E.
coli (GeneID: 6060756) из базы данных GenBank. Использовали следующую пару праймеров:
«прямой» – (5¢-ATATTACATATGAGCTTACTCAACGTCCCTGCGGGTAAAG-3¢) и «обратный» –
(5¢-CAGGTCGACTTATTTATTCTTTGCGCGCTCG-AAGGA-GGC-3¢). В 5¢-конец прямого праймера был встроен сайт
рестрикции эндонуклеазы NdeI, а в обратный праймер – сайт узнавания
рестриктазы SalI (выделены жирным шрифтом). Для проведения
реакции амплификации использовали Go-Taq-полимеразу (Promega, США). На электрофореграмме (рисунок 1)
синтезированного с помощью ПЦР продукта видно, что полученный ампликон имеет
размер ~ 500 п.о., что соответствует размеру гена ppa [3]. При этом можно отметить высокую интенсивность амплификата при
отсутствии неспецифических продуктов.
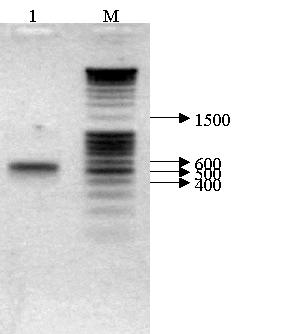
М – маркер (GeneRuler 100 bp DNA Ladder Plus, Fermentas, Литва); 1 – продукт амплификации
Рис. 1 – Электрофореграмма результатов ПЦР-амплификации
гена неорганической пирофосфатазы E. coli
Далее полученную вставку
гена ppa выделяли из агарозного геля, обрабатывали смесью
рестриктаз NdeI и SalI и встраивали в вектор pET24b+, обработанный
смесью тех же рестриктаз и щелочной фосфатазой для предотвращения
самолигирования плазмиды. Полученной лигазной
смесью трансформировали штамм E. coli
DH5α. Данный штамм использовался для начальной
наработки и анализа полученных векторов, поскольку в нем отсутствует система
репарации ДНК (recA-) и эндонуклеаза
(endA-).
При анализе полученных
трансформантов E. coli
DH5α на наличие плазмиды, несущей вставку гена ppa, с
помощью ПЦР-анализа с использованием праймеров, к 5′-концу гена и Т7-терминатору,
находящегося в плазмиде, был отобран клон E. coli
DH5α, несущий необходимую плазмиду, названную pETрра8. Клетки данного клона были использованы для наработки
целевой плазмиды в необходимом количестве.
На следующем этапе работы
отобранной плазмидой была проведена трансформация клеток E. coli BL21(DE3) и получен
клон, названный E. coli рра8.
Полученные клетки выращивали до
оптической плотности 0,6 (λ = 600 нм); и подвергали индукции с помощью 1 мМ ИПТГ в течение
5 ч. Продукт гена с молекулярной массой, приблизительно соответствовавшей
размеру ожидаемого продукта (около 20 кДа на мономер), накапливался в количестве
не менее 40% от общего белка, о чем свидетельствовали результаты SDS-полиакриламидного гель-электрофореза.
Неорганическая
пирофосфатаза E. coli является термостабильным ферментом [4]. Так как при
нагревании до 80оС большинство белков E. coli денатурируют
и выпадают в осадок, а пирофосфатаза при этом сохраняет свою активность, эту
процедуру мы использовали для очистки изучаемого фермента. На первом этапе проводили
прогревание лизата в течение 10 мин в присутствии 10 мМ хлорида магния. На
следующем этапе работы полученный частично-очищенный фермент (супернатант) наносили
на хроматографическую колонку с ДЭАЭ-целлюлозой. Таким образом, нами был получен очищенный белок, о чем свидетельствуют
результаты SDS-полиакриламидного
гель-электрофореза (рисунок 2).
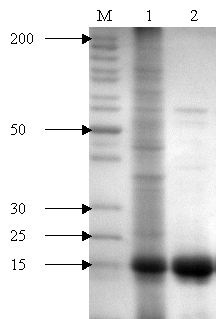
М – положение
и молекулярные массы (кДа) стандартных белков; 1 – лизат клеток E. coli рра8; 2 – препарат фермента после очистки
Рис. 2 – Электрофоретический анализ неорганической
пирофосфатазы до и после ее очистки
Использование данной схемы
очистки позволило нам очистить неорганическую пирофосфатазу в 2,3 раза с
выходом 23,7%.
На следующем этапе работы частично
очищенная пирофосфатаза была использована в реакции синтеза Ар4А. При
внесении в стандартную реакционную смесь [5] 0,5 ед.
полученного фермента выход целевого продукта достигал 95%. Такой же результат
получен при использовании 0,5 ед. коммерческой неорганической пирофосфатазы (Serva,
Германия). В отсутствии этого дополнительного фермента Ар4А не
образовывался.
Таким образом, нами был получен рекомбинантный
штамм-продуцент неорганической пирофосфатазы E. coli рра8.
Данный штамм обладает повышенной пирофосфатазной активностью (таблица 1).
Таблица
1
|
Пирофосфатазная
активность различных штаммов-продуцентов |
||
|
Штаммы E. coli |
Активность, ед./мг сухих клеток |
Источник |
|
Дикий тип |
840 |
[4] |
|
E. coli ppa8 |
724 500±36 200 |
- |
|
E. coli RT4 |
29 400 |
[3] |
Из таблицы 1 видно, что штамм E. coli ppa8
обладает активностью, превышающей в 862,5 раза активность нерекомбинантного
штамма, и в 24,6 раза – активность полученного ранее рекомбинантного штамма [3].
Литература:
1. Kikuta Y., Ohiwa E., Okada K., Watanabe A., Haruki S. Clinical application of diadenosine tetraphosphate (Ap4A:F-1500) for controlled hypotension // Acta Anaesthesiol. Scand. 1999.
Vol. 43, N 1. P. 82–86.
2. Theoclitou M.-E., Witting E.P.L., Hindley A.D., El-Thaher T., Miller
A.D. Characterisation of stress protein LysU. Enzymatic synthesis of
diadenosine 5',5'''-P1,P4-tetraphosphate
(Ap4A) analogues by LysU // J. Chem. Soc., Perkin Trans. 1996. Vol.
1. P. 2009–2019.
3. Lahti R., Pitkäranta T., Valve E., Ilta I.,
Kukko-Kalske E., Heinonen J. Cloning and characterization of the gene
encoding inorganic pyrophosphatase of Escherichia
coli K-12] // J. Bacteriol. – 1988. – Vol. 170, N
12. – P. 5901–5907.
4.
Josse J. Constitutive inorganic pyrophosphatase of Escherichia coli. 1. Purification and catalytic properties // J.
Biol. Chem. – 1966. – Vol. 241, N 9. – P. 1938–1947.
5. Квач С.В.,
Бурко Д.В. Повышение уровня экспрессии гена lysU Escherichia coli путем создания генно-инженерного штамма-суперпродуцента
лизил-тРНК-синтетазы // Весцi НАН Беларусi. Сер. бiял. навук. – 2006. – № 5. – С. 82–84.