Ерошевская
Л.А., Береснев А.И. *, Квач С.В., Зинченко А.И.
Институт микробиологии НАН Беларуси, Минск, Беларусь
*Международный
государственный экологический университет
им. А.Д. Сахарова, Минск
Биокаталитический
Синтез
9-ß-D-арабинофуранозилгуанина
с
использованием бактериальных
ферментов
Модифицированные
аналоги гуанозина используются в качестве противоопухолевых и противовирусных
средств, а также как исходные субстраты для синтеза олигонуклеотидных
лекарственных субстанций [1, 2]. 9-ß-D-арабинофуранозилгуанин (ара-Г), как и его более водорастворимое
«пролекарство» – 6-метокси-ара-Г (неларабин), является мощным
противолейкемическим агентом [3–5], демонстрирующим селективную цитотоксичность
в отношении Т-лейкемических клеток.
Химические способы синтеза
ара-Г многостадийны и предусматривают использование экологически небезопасных
реагентов [6, 7]. Удобной альтернативой химическим способам синтеза
модифицированных пуриновых нуклеозидов являются биокаталитические методы,
предусматривающие применение ферментативного трансгликозилирования [2, 8, 9]. Однако
чрезвычайно слабая растворимость гуанина препятствует практическому использованию
этого гетероциклического основания в качестве акцептора арабинозного остатка. Например, при использовании в качестве источника
уридинфосфорилазы (УРФ) и пуриннуклеозидфосфорилазы (ПНФ) целых клеток Enterobacter aerogenes в реакции синтеза ара-Г из урациларабинозида
(ара-У) и гуанина в молярном соотношении 3:1 выход ара-Г не превышает 8% [10]. В
тоже время, в аналогичных условиях реакция синтеза арабинозида аденина
протекает с выходом 92% [11]. Значительно более высокого выхода ара-Г удается
достичь при замене гуанина: на 2-хлоргипоксантин с последующим химическим
аминированием 2-хлоргипоксантинарабинозида (общий выход 30%) [12], на гуанозин
(выход реакции 45%) [10] или на 2'-дезоксигуанозин (выход 44–59%) [13].
В литературе [14]
недавно предложено для синтеза ара-Г использовать последовательно два
биокатализатора в виде целых клеток бактерий Enterobacter gergoviae, проявляющих УРФазную и ПНФазную
активности, и Arthrobacter oxydans, обладающих активностью аденозиндезаминазы
(АД). Реакционную смесь, содержащую 2,6-диаминопурин (10 мМ) и ара-У (30 мМ) в
30 мМ калий-фосфатном буфере (рН 7,0), инкубировали 48 ч при 60°С с клетками Enterobacter gergoviae. После центрифугирования реакционной
смеси в супернатант внесли клетки Arthrobacter oxydans и продолжили инкубирование при
37°С в течение 72 ч. Волуметрический выход ара-Г составил 1,02 г/л (при степени
конверсии 2,6-диаминопурина в ара-Г 36%).
В настоящем исследовании
мы синтезировали ара-Г с помощью УЗ-лизатов клеток рекомбинантных штаммов Escherichia coli, продуцирующих УРФ, ПНФ и АД. Гены, кодирующие эти ферменты, были выделены
из геномной ДНК E. coli с
помощью полимеразной
цепной реакции (ПЦР) и известных
праймеров. Конструирование рекомбинантных плазмид, содержащих указанные
гены, и трансформацию ими клеток E. coli BL21(DE3) проводили согласно стандартным протоколам. Условия
культивирования трансформантов и индукции синтеза ими рекомбинантных ферментов
описаны нами ранее [15, 16].
Активность УРФ и ПНФ
определяли в реакции фосфоролиза уридина и инозина, соответственно. Активность
АД оценивали по реакции дезаминирования аденозина. Концентрации продуктов
реакции измеряли спектрофотометрически после проведения тонкослойной
хроматографии, используя известные коэффициенты молярной экстинкции. За единицу
активности ферментов принимали такое их количество, которое обеспечивало образование
1 мкмоль продукта за 1 мин в соответствующих условиях проведения реакций.
Схема синтеза ара-Г
тремя рекомбинантными ферментами представлена на рисунке. На первой стадии процесса
из ара-У (75 мМ) и 2,6-диаминопурина (50 мМ) в 60 мМ калий-фосфатном буфере (рН
7,0) под действием УРФ (20 ед/мл) и ПНФ (40 ед/мл) в течение 24 ч при 60ºС
с выходом 95% был синтезирован 2,6-диаминопуринарабинозид. После выделения
продукта из реакционной смеси кристаллизацией на холоду его растворили в 0,1 М
Трис-HCl-буфере (рН 8) и количественно дезаминировали с помощью АД (25
ед/мл) при 37ºС в течение 24 ч. Степень трансформации исходного
2,6-диаминопурин-арабинозида составила 90%. Волуметрический выход ара-Г составил
12,06 г/л.
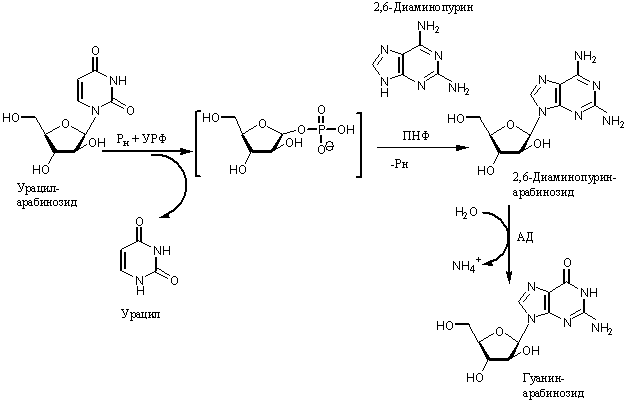
Рисунок 1 – Схема биокаталитического
синтеза ара-Г
В заключение следует
подчеркнуть, что при прочих равных условиях использование ферментов микробного
происхождения имеет преимущество перед ферментами, изолированными из клеток
животных, поскольку в последнем случае существует вероятность передачи
прионовой инфекции.
Литература:
1. Herrström Sjöberg A., Wang L., Eriksson S. // Antimicrob. Agents Chemother. – 2001. – Vol. 45. – P. 739–742.
2. Mikhailopulo I.A. // Curr. Org. Chem. – 2007. – Vol. 11. – P. 317–335.
3. Buie L.W., Epstein S.S., Lindley C.M. // Clin. Ther. – 2007.
– Vol. 29, № 9. – P. 1887–1899.
4. Czuczman M.S., Porcu P., Johnson J. et al. // Leukemia, Lymphoma. –
2007. – Vol. 48, № 1. – P. 97–103.
5. Sigalas P., Tourvas A.D., Moulakakis A.
et al. // Leukemia Res. – 2009. – Vol. 33, № 7. – P. 61–63.
6. Lee W.W., Martinez A.P., Goodman L. et al. // J. Org. Chem. – 1972. – Vol. 37, №
19. – P. 2923–2927.
7. Yu X.J., Li G.X., Qi X.X., Deng Y.Q. // Bioorg. Med. Chem. Lett. – 2005. – Vol. 15, № 3. – P. 683–685.
8. Utagawa
T. // J. Mol. Catal. B: Enzym. – 1999. – Vol. 6, № 3. – P. 215–222.
9. Зинченко А.И. //
Первый съезд ученых Республики Беларусь (Минск, 1–2 нояб. 2007 г.). – Минск: Белорус.
наука, 2007. – С. 396–404.
10. Utagawa T., Hirose Y. // J. Synth. Org. Chem. Jap. – 1983. – Vol.
41, № 11. – P. 1076–1087.
11. Utagawa T., Morisawa H., Miyoshi T.
et al. // FEBS Lett. – 1980. –
Vol. 109, № 2. – P. 261–263.
12. Morisawa H., Utagawa T., Miyoshi T. et al. // Tetrahedron Lett. –
1980. –
Vol. 21, № 5. – P. 479–482.
13. Zinchenko A.I., Barai V.N., Bokut S.B. et al.
// Appl. Microbiol. Biotechnol. – 1990. – Vol. 32, № 3. – Р. 658–661.
14. Medici R., Iribarren A.M., Lewkowicz E.S. // Bioorg. Med. Chem. Lett. – 2009. –
Vol. 19, № 15. – P. 4210–4212.
15. Квач С.В.,
Ерошевская Л.А., Зинченко А.И. и др. // Новейшие достижения в области
импортозамещения в химической промышленности: матер. междунар. конф. – Мн.,
25–27 нояб. 2009 г. – Мн.: БГТУ, 2009. – Ч 2. – С. 25–29.
16. Ерошевская Л.А.,
Квач С.В., Зинченко А.И. // Современные проблемы физиологии, экологии и
биотехнологии микроорганизмов: матер. Всерос. симп. с междунар. участием,
Москва, МГУ, 24–27 дек. 2009 г. – Москва: МАКСПресс, 2009. – С. 61.