Петкевич
М.В.*, Рымко А.Н.*, Квач
С.В., Зинченко А.И.
Институт
микробиологии НАН Беларуси, Минск, Беларусь
*Международный государственный
экологический университет
им. А.Д. Сахарова, Минск
Получение магнитных наночастиц, пригодных
для сорбции ДНК
Применение
наноматериалов в медицине и фармакологии является приоритетным направлением,
позволяющим решать самые актуальные проблемы в данных
областях знаний [1–3].
Наночастицы
обладают высокоразвитой активной поверхностью и, как следствие, высокой
сорбционной емкостью. Важно отметить, что иммобилизация на поверхности
наночастицы приводит к стабилизации биомолекул и служит защитой от деградации
их под воздействием различных факторов. Показано, что ДНК, иммобилизованная на
поверхности наночастицы, сохраняет свою стереометрию и устойчива к действию
нуклеаз.
Магнитные
наночастицы нашли широкое применение в диагностике in vitro. Разработан высокочувствительный метод цитометрического
анализа образцов цельной крови, в основе которого лежит маркировка клеток крови
ферромагнитными наночастицами. Магнитные наночастицы, сопряженные с антителами,
используются для обнаружения опухолевых клеток в периферической крови, что
позволяет оценивать эффективность химиотерапии, а также выделять клетки методом
магнитной сепарации.
Очевидны
перспективы использования магнитных наночастиц in vivo для диагностики и терапии. В настоящее время наночастицы,
покрытые кремнием, для MRI-обнаружения опухолей различной локализации являются
коммерческими продуктами. Свойство индуктивного нагревания наночастиц позволило
разрабатывать идею их использования для гипертермического разрушения опухолевых
клеток. Широко разрабатываются подходы к генотерапии онкологических
заболеваний. В настоящее время проведены эксперименты по трансфекции генов с
использованием суперпарамагнитных частиц на
клетках эпителия легкого человека. Доставка специфических ДНК, РНК,
олигонуклеотидов в определенные клетки может подавлять экспрессию гена либо
инициировать синтез важных белков.
Таким
образом, сегодня открываются перспективы для проведения высокочувствительной
диагностики и высокоспецифичной и эффективной терапии различных
заболеваний с помощью магнитных наночастиц. Постоянно синтезируется большое
число новых наноматериалов и предлагаются новые подходы в области их биомедицинского
применения.
В настоящее время существует огромное количество способов синтеза магнитных
наночастиц. Одни из них – одностадийные, другие – многостадийные процессы. Все
они имеют свои плюсы и минусы, но ни один из них не является универсальным для
синтеза всех типов магнитных наночастиц.
Цель
настоящего исследования – получение силанизированных магнитных
наночастиц и проверка возможности их использования в качестве сорбента ДНК.
Материалы
и методы исследования. Для получения магнитных наночастиц к 20 мл 1 М раствора NH4OH добавляли 20
мл раствора, содержащего 0,1 М FeSO4 и 0,1 M FeCl3. Процедуру
смешивания проводили в вытяжном шкафу, покапельно, с постоянным перемешиванием
реакционной смеси. Полученную суспензию прогревали при 120°С в течении 15 мин.
После остывания суспензии полученный магнетит (Fe3O4) дважды промывали 96%
этанолом.
Для силанизации наночастиц к магнетиту при
постоянном перемешивании в строгой последовательности добавляли 16,7 мл 96%
этанола (до конечной концентрации 80%), 2,7 мл дистиллированной воды, 0,2 мл NH4ОН и 0,4
мл тетраэтоксисилана. Полученную
суспензию силанизированных наночастиц трижды промывали этанолом, помещали в
водную среду и оставляли на «старение» на 3 сут. Для проверки качества силанизации
наночастиц к 100 мкл суспензии магнетита добавляли 100 мкл 2 М НСl и после 2 ч проведения реакции замеряли оптическую
плотность супернатанта при λ=295 нм.
Просвечивающую электронную микроскопию
осуществляли, используя микроскоп JEM-100CX при ускоряющем напряжении 80 кВ.
Образцы наносили на сетчатые никелевые мишени с нитроцеллюлозной подложкой и
высушивали на воздухе в течение ночи.
Сорбцию ДНК на
магнитные наночастицы проводили
следующим образом. В пробирку на 1,5 мл вносили 50 мкл раствора геномной ДНК Escherichia сoli с концентрацией 5
мкг/мкл, 500 мкл 6 М NaClO4 в 0,1 М натрий-ацетатном буфере (pH 5,2),
100 мкл изопропанола и 50 мкл 50% суспензии магнетита. После тщательного
перемешивания пробирку помещали на магнитный штатив и с помощью пипетки
отбирали супернатант. К осадку добавляли 1 мл 80% этанола в 10 мМ трис-НСl (pH
8,0), перемешивали и снова отбирали супернатант. К осадку добавляли 1 мл 5%
этанола, отбирали супернатант и приливали 100 мкл 10 мМ трис-НСl (pH 8,8). Полученную
смесь помещали на водяную баню (70°С) на 5–10 мин, после чего отбирали
супернатант для измерения в нем количества ДНК. Для количественного определения
ДНК к 10 мкл супернатанта прибавляли 190 мкл 6-тикратного интеркалирующего
красителя Sybre green (Sigma, США) в 10 мМ трис-НСl (pH 8,0), после чего
замеряли величину флуоресценции.
Для определения возможности использования
ДНК, десорбированной с магнитных наночастиц, в генно-инженерных исследованиях образец
такой ДНК вносили в реакционную смесь следующего состава: 67 мМ трис-HCl (pH
8,3), 17 мМ (NH4)2SO4, 2 мМ MgCl2, 0,02%
Твин-20, каждый из четырех природных дезоксинуклеозидтрифосфатов в концентрации
0,02 мМ, 10 пмоль праймеров к последовательности гена уридинфосфорилазы E. coli и 1
ед. Taq-ДНК-полимеразы. В качестве
положительной пробы использовали ДНК E.
сoli, в качестве отрицательной пробы – воду. Амплификация выполнялась по
программе: 2 мин 94ºС, (30 сек 94ºС; 15 сек 55ºС; 2 мин 30 сек
72ºС) – 25 циклов; 2 мин 72ºС. Продукты амплификации разделяли путем
электрофореза в 1%-ном агарозном геле.
Результаты
исследования. Синтез магнитных наночастиц,
осуществленный по представленной выше методике позволил получить 20 мг
магнитных наночастиц.
Одной
из особенностей поведения наночастиц в растворе является их склонность к
агрегации, поэтому для практического использования растворов магнитных
наночастиц необходима их стабилизация. После покрытия наночастиц SiO2
их масса увеличилась до 25 мг. УФ-спектрофотометрические исследования показали,
что магнитные наночастицы полностью силанизированы и устойчивы к действию
соляной кислоты.
На
полученных микрофотографиях магнитные наночастицы имели вид крупных агрегатов,
состоящих из частиц меньшего размера. Маленькие частицы выглядели довольно
гомогенными и имели округлую форму. Размер их колебался от 15 до 25 нм с
диаметром ядра 15–20 нм и силановым слоем около 5 нм.
В
результате проведенных экспериментов было показано, что полученные нами
магнитные наночастицы с сорбированной ДНК способны высвобождать до 65% исходной
ДНК. Исходя из результатов измерений, в процессе сорбции с 1 мг полученного
сорбента десорбировалось 32,4 мкг ДНК.
Проведенная полимеразная цепная реакция
показала, что десорбированная с магнитных наночастиц ДНК является хорошим
объектом для дальнейших генно-инженерных исследований. Анализ ДНК проводили с
помощью агарозного гель-электрофореза. На электрофореграмме (рисунок 1) видно,
что опытные образцы содержат около 700 п.о. и соответствуют контрольному.
Таким образом, в результате проведенных экспериментов получены покрытые
оксидом кремния магнитные наночастицы, обладающие хорошей ДНК-сорбционной
способностью. Выход сэлюированной ДНК составил 32,4 мкг нуклеиновой кислоты на
1 мг магнитных наночастиц, а эффективность выделения ДНК составляет 65% от
исходного количества. Показано, что выделенная с
помощью магнетита ДНК пригодна для постановки ПЦР.
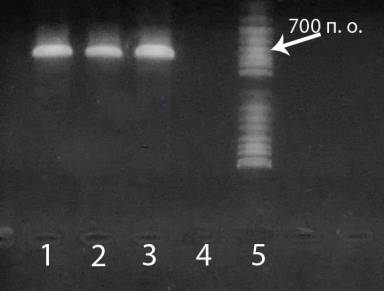
Рисунок 2 – Электрофореграмма продуктов
амплификации гена уридинфосфорилазы E. coli
1–2
– ДНК, элюированная с магнитных наночастиц; 3 – исходная ДНК; 4 - отрицательный
контроль; 5 - фрагменты ДНК с известным числом оснований
Разработанный способ получения магнитных наночастиц не требуют
использования энергоемкой и сложной вакуумной и высокотемпературной техники, он
экологически безопасен и относительно прост, что делает его перспективным для
практического использования.
Литература:
Riehemann K., Schneider S.W., Luger T.A., Godin B., Ferrari M., Fuchs H. Nanomedicine – challenge
and perspectives // Angew.
Chem. Int. Ed. Engl. 2009. Vol. 48, N 5. P. 872–897.
Sakamoto
J.H., van de Ven A.L., Godin B. et. al. Enabling
individualized therapy through nanotechnology // Pharmacol. Res.
2010. Vol. 62, N 2. P. 57–89.
Sniadecki N.J. Minireview: a tiny touch: activation of cell
signaling pathways with magnetic nanoparticles
// Endocrinol. 2010. Vol. 151, N 2. P. 451–457.