Биологические науки/ 9. Биохимия и биофизика
К.б.н.,
Русецкая Н.Ю.1, д.х.н. Древко Б.И.2, д.м.н. Бородулин
В.Б.1
Саратовский
государственный медицинский университет им. В.И. Разумовского, Россия1,
Саратовский государственный аграрный университет им. Н.И. Вавилова, Россия
2
Сравнительная антиоксидантная активность селеноорганического соединения
диацетофенонилселенида и его галогенопроизводных
В последние годы отмечено, что структура рациона
современных людей претерпела изменения, получил широкое распространение дефицит
многих витаминов, эссенциальных микроэлементов, в том числе и селена. Для
профилактики селенодефицита предлагаются токсичные неорганические соединения
селена (селенит и селенат натрия). Селеноорганические соединения менее токсичны
и более биодоступны по сравнению с неорганическими формами [1].
Селеноорганическое соединение диацетофенонилселенид (ДАФС-25) обладает
выраженной антиоксидантной, антитоксической, иммуномодулирующей активностью и успешно
применяется в птицеводстве и животноводстве ряда регионов России. ДАФС-25 [2].
В связи с этим, целью нашей работы явилось изучение
сравнительной антиоксидантной активности селеноорганического соединения
диацетофенонилселенид (ДАФС-25) и его хлор- и фторпроизводных.
Материалы и методы.
В работе использовали селеноорганический препарат
ДАФС-25 (препарат 1), его хлорпроизводное (препарат 2) и фторпроизводное (препарат
3), которые были синтезированы под руководством д.х.н., профессором Б.И. Древко
(см. рис. 1).
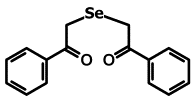

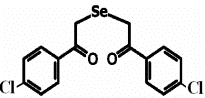

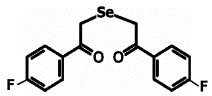

Препарат 1 Препарат 2 Препарат 3
Рис. 1. Препараты, использованные в работе: препарат 1
- 1,5-дифенил-3-селенапентандион-1,5
(ДАФС-25), препарат 2 - 1,5-ди-(п-хлорфенил)-3-селенапентандион-1,5, препарат 3 - 1,5-ди-(п-фторфенил)-3-селенапентандион-1,5
Все препараты растворяли в растительном масле.
Эксперимент проводили на самцах белых беспородных мышей возрастом 2 месяца и
массой 20 г. Каждая группа мышей включала 8 животных. Животным первой группы
(контроль) вводили per os растительное масло в количестве 10 мкл. Животных 2, 3 и 4 групп вводили per os
препараты 1, 2 и 3 соответственно в количестве 10 мкл, с дозой 800 мкг/кг.
Эксперимент проводили в течение 14 дней. Кровь забирали из вены сафена (saphenous vein) в пробирку с гепарином [3]. В цельной крови определяли активность
фермента глутатионпероксидазы (ГПО) на полуавтоматическом анализаторе «Hospitex Screen master plus» с использованием наборов реактивов фирмы «Randox» (UK). После центрифугирования цельной крови получали
плазму и эритроциты, в которых определяли активность ферментов
супероксиддисмутазы (СОД) [4] и каталазы [5], а также содержание малонового
диальдегида (МДА) [6]. Определение проводили на фотоэлектроколориметре КФК-3. Статистическую обработку экспериментальных данных
проводили с использованием программы Microsoft Excel на персональном
компьютере. Статистическая обработка данных включала расчет следующих
параметров: М - средняя арифметическая, m - ошибка средней арифметической, s - среднее квадратичное отклонение. О достоверности
отличий учитываемых показателей контрольной и опытной групп судили по величине
t-критерия Стъюдента для прямых разностей сопряженных данных.
Результаты и их обсуждение.
Исследованные селеноорганические соединения 1 и 2 обладали
антиоксидантной активностью, что выражалось в увеличении активности
антиоксидантных ферментов и снижении содержания МДА в гемолизате эритроцитов и
плазме крови. Активность
селенсодержащего фермента ГПО в цельной крови увеличивалась на 60% (препарат 1),
47% (препарат 2) и 42% (препарат 3); активность каталазы в гемолизате
эритроцитов возрастала на 180% (препарат 1) и 329,1% (препарат 3), а в плазме крови
- на 113% (препарат 2) и 107,5% (препарат 3) соответственно (р<0,05). Все
исследованные препараты значительно увеличивали активность СОД в гемолизате
эритроцитов по сравнению с контролем (см. таблицу 1).
Таблица 1. Антиоксидантная активность селеноорганических
соединений 1,2 и 3
|
Группы животных |
ГПО |
СОД |
каталаза |
МДА |
|||
|
гемолизат эритроцитов |
плазма |
гемолизат эритроцитов |
плазма |
гемолизат эритроцитов |
плазма |
||
|
1 |
918,25±
121,13 |
1405,08± 205,5 |
1076,83±154,82 |
31,3±1,2 |
13,3± 0,7 |
8,1±1,5 |
0,85± 0,54 |
|
2 |
1469± 172,07* |
13295,83± 1574,1* |
1683,17±214,3* |
88,0±11,3* |
12,5± 1,6 |
4,16±0,41* |
0,47± 0,06* |
|
3 |
1349± 115,2* |
9562± 789,6* |
542,79±67,74* |
44,7±7,9 |
27,8± 4,9* |
1,9±0,3* |
0,92± 0,1 |
|
4 |
1307,75±125,0* |
7062,8± 919,48* |
1770,6±291,75* |
134,3±37,3* |
27,6± 3,1* |
6,7±0,8 |
1,6± 0,2* |
Пересчет проводили на 1 мл
для плазмы и эритроцитов.
* - <0,05
Важным показателем антиоксидантной активности
препарата является подавление пероксидации липидов и, следовательно, снижение
содержания ТБК-активных продуктов (МДА). Содержание МДА достоверно снижалось в
гемолизате эритроцитов на 50% (препарат 1) и 76,6% (препарат 2) и в плазме на
50% (препарат 1). При изучении антиоксидантной активности препарата 3
обнаружилось достоверное увеличение концентрации МДА в плазме крови на 84% (р<0,05).
Следовательно, несмотря на повышенную активность антиоксидантных ферментов,
препарат 3 проявлял прооксидантную активность (см. таблицу 1).
Заключение. Среди изученных селеноорганических
соединений препарат 1 обладал большей антиоксидантной активностью по сравнению препаратами
2 и 3. Фторпроизводное препарата ДАФС (препарат 3) обладало прооксидантным
действием. Вероятно, наличие двух атомов фтора в пара-положении фенильных
заместителей препарата ДАФС (см. рис. 1) обусловливает окислительные свойства
препарата 3 и его прооксидантное действие in vivo. Выраженная
антиоксидантная активность препарата 1 обусловлена, как предполагается, тремя
основными механизмами: во-первых, включением селена в активный центр главного
антиоксидантного фермента ГПО, во-вторых, метаболической модификацией этого
соединения с образованием гидроксилированных производных при участии
микросомальных ферментов печени (гидроксил, связанный с бензольным кольцом,
является реакционным центром для всех фенольных антиоксидантов, таких как
токоферол, убихинон и т.д.) [7] и, в-третьих, за счет способности разлагать
гидроперекиси липидов непосредственно в структуре биомембран благодаря восстановительным
свойствам селена [8].
Литература.
1.
Гмошинский И.В., Мазо В.К. Селен в питании: краткий обзор.// Medicina Altera.-1999.-№
4.-С.18-22.
2.
Древко Б.И., Антипов В.А., Жуков О.И. и др. Средство для лечения и профилактики болезней,
вызываемых недостаточностью селена в организме сельскохозяйственных животных и
птиц. Пат. № 2051681 РФ // Бюл. изобрет. - 1996. - № 1.
3.
Hem A., Smith A.J. &
Solberg P. Saphenous vein puncture for blood sampling of the mouse, rat, hamster,
gerbil, guinea pig, ferret and mink // Laboratory Animals. 1998. Vol. 32. P. 364-368.
4.
Дубинина Е.Е.,
Сальникова Л.А., Ефимова Л.Ф.
Активность и изоферментный спектр супероксиддисмутазы эритроцитов и плазмы крови человека // Лаб.
дело. – 1983. – №10. – С. 30-33.
5.
Медицинские лабораторные технологии. Справочник / Под редакцией А.И.
Карпищенко. В 2-х томах. Т.2. С. 27-28.
6.
Стальная И.Д., Гаришвили Т.Г. Метод определения малонового диальдегида с помощью
тиобарбитуровой кислоты // Современные методы в биохимии / Под ред. В.Н.
Ореховича. М.: Медицина, 1977. - С. 66-68.
7.
Зайцев В.Г., Островский О.В., Закревский В.И. Связь между химическим
строением и мишенью действия как основа классификации антиоксидантов прямого
действия // Эксперим. клин. фармакол.– 2003.– Т.66, № 4.– С.66-70.
8.
Кирова Ю.И.
Антиоксидантное и антитоксическое действие новых селеноорганических соединений:
Дис. ... канд. биол. наук: 03.00.04: Ростов н/Д, 2004. 186 c.