Хімічні науки / неорганічна хімія
М.Д. Волошин, д.т.н., проф., О.А. Крюковська к.т.н., доцент,
маг. А.Ю.Ружина, маг. Т.М.Бойко
Дніпродзержинський
державний технічний університет (ДДТУ), Україна
Отримання хлору методом електролізу
Україна має
досить високий рівень забезпечення населення централізованим водопостачанням та
водовідведенням. Середньодобове споживання води на одного міського жителя в
Україні становить 320 літрів.
На сьогоднішній день
для дезінфекції водопровідної води, як правило, застосовується газ хлор, який належить до
2-го класу небезпеки відповідно до ДСТ 12.1.005 (високонебезпечна речовина). Робота з хлором вимагає спеціальних заходів безпеки, бо хлор як отруйна речовина представляє велику
небезпеку в процесі його виробництва, перевезення, зберігання і застосування. До того ж одним з
головних недоліків сучасного хлорування води є утворення галогенових сполук,
більшу частину яких становлять тригалометани, а саме: хлороформ,
діхлорбромметан, дібромхлорметан і бромоформ, які остаточно залишаються в
обробленій воді й небезпечно впливають на людину при потраплянні до її
організму, а саме призводять до злоякісних новоутворень в шлунку та кишечнику [1].
Як
альтернативу хлоруванню для знезараження води рекомендуємо застосування
технології оксидантів за спеціальною електрохімічною технологією. Проходження
електричного струму через розчин супроводжується ланцюгом електрохімічних
реакцій, в результаті яких у воді утворюються нові речовини й змінюється
структура міжмолекулярних взаємовідносин [2].
Для отримання
хлору з метою знезараження води в лабораторних умовах було сконструйовано лабораторний електролізер (рисунок 1), в
якому використовували хлорид натрію та хлорид калію. Схема лабораторної установки
для дослідження технології одержання хлору складається із джерела струму, що
подає постійний струм силою до 5А. Регулювання сили струму здійснюється за
допомогою резистора та показаннями амперметра і вольтметра. Струм
проходить через катод та анод електролізера, які відокремлені діафрагмою. Газова суміш, що виділяється під дією струму
на розчин солі з електролізера, відводиться за
допомогою трубки у газометр. Кількість утвореної газової суміші відповідає
об’єму витісненої рідини із газометра у мірний циліндр.
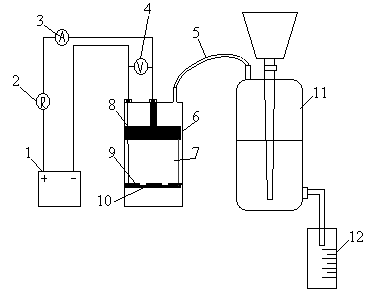

Рисунок 1 – Схема лабораторної
установки електролізу для одержання
хлору та інших оксидантів (1 –джерело струму; 2 – резис-тор; 3 –
амперметр; 4 – вольтметр; 5 – трубка для проход-ження газової суміші; 6 –
електролізер; 7 – розчин солі; 8 – анод; 9 – діафрагма; 10 – катод; 11 –
газометр; 12 – мірний циліндр)
Технічна
характеристика установки електролізу представлена у таблиці 1.
На прикладі з
хлоридом натрію, який більш зручний та економічний для застосування, реакція
утворення хлору наступна. Сіль, розчинена у воді, під час електролізу на аноді
формувала хлор, а у катода утворювався гідроокис натрію.
2NaCl + H2O → 2Na+ +2Cl– +
2H2O
2Cl– → Cl2+2e–
Na+ + OH– → NaOH
Таблиця 1 -
Технічні характеристики установки електролізу
|
№ пп |
Найменування |
Технічні параметри |
Матеріал |
|
1 |
Блок живлення |
до 5А |
- |
|
2 |
Резистор |
19 Ом ±10% |
- |
|
3 |
Амперметр |
0 ÷ 3А |
- |
|
4 |
Вольтметр |
0 ÷ 10В |
- |
|
5 |
Електролізер |
V = 10-3 м3 Vрозсолу = 0,5·10-3 м3 |
Корпус – скло; кришка - |
|
6 |
Катод |
D = 0,075 м |
Сталь 20 |
|
7 |
Анод |
D = 0,075 м H = 0,01 м |
Графіт |
|
8 |
Діафрагма |
D = 0,1 м |
Азбест |
Ця реакція нетривала, бо хлор, сформований у аноду, швидко використовується
для утворення гіпохлориду натрію.
Cl2
+ 2NaOH → H2 + 2NaOCl
Таким чином в процесі електролізу води генерується суміш потужних
окислювачів.
Супутнім позитивним чинником використання електролізу є зменшення
жорсткості води. Під час електролізу в
електромагнітному полі водородна частина води притягується до катоду, а киснева
частина – до аноду. Це призводить до послаблення й навіть розриву водородних
зв’язків у молекулі води та сприяє утворенню атомарного кисню, наявність якого
у воді сприяє зменшенню жорсткості води бо гідрат окису кальцію досить добре
розчиняється у воді [3].
Са2+ + О2-
→ СаО
СаО + Н2О →
Са(ОН)2
Знезаражування води прямим електролізом є різновидом окислювальної обробки
води, але кардинально різниться від поширених методів знезаражування тим, що
окислювачі виробляються з самої води, а не додаються ззовні й, виконав
необхідну функцію, не утворюють небажаних речовин. Ефективність знезаражування
води прямим електролізом, на наш погляд, в декілька разів вище порівняно з
хімічними методами. Для прямого електролізу не потребуються дозуючі насоси й
використання реагентів. Хлор, необхідний для попередження вторинного
бактеріального забруднення води в розподільчих мережах, активується з природних
мінеральних солей, що містяться у воді, а потім швидко в ній розчиняється.
Прямий електроліз руйнує хлораміни та перетворює їх в азот й сіль. Значний
економічний ефект також присутній, бо відомо, що в собівартість питної води для
споживачів закладена суттєва складова – електрична енергія. А на генерацію
хлору прямим електролізом витрачається менше електроенергії, чим при
традиційних технологіях очистки води.
Висновки.
1.
Знезараження питної води в України здійснюється шляхом хлорування. На
станціях підготовки води прагнуть уникнути використання стисненого хлору,
застосовуючи інші дезінфектанти чи способи їх генерації безпосередньо перед
подачею у воду.
2.
Серед пристроїв для
генерації активного хлору на місці споживання найбільш привабливими з так
званої ефективності та зручності в експлуатації є електролізні установки.
3.
Крім безпеки експлуатації, електролізні установки мають ще одну
перевагу - можливість оперативного
управління продуктивністю щодо активного хлору зміною напруги на клемах
електролізера, що дозволяє реалізувати динамічну оптимізацію процесу
знезараження залежно від витрати та якості води, яка подається споживачам.
В подальшому планується дослідити вплив сили струму, температури розсолу в
електролізері, зміни відстані між катодом і анодом на кількість утворення
суміші газів під час електролізу води.
Література
1.
Экология и здоровье
человека. Охрана водного и воздушного басейнов. Утилизация отходов: [Сборник научных
трудов]. – Харьков-Алушта., 2005. – 959с.
2.
Практикум по прикладной электрохимии: Учебное пособие
для вузов / Под ред. Н.Т. Кудрявцева. –Л.: Химия, 1980.
– 288 с.
3.
Якименко Л.М. Производство водорода, кислорода, хлора и щелочей. - М.: Химия, 1981. – 280 с.
4.
Б.Б. Дамаскин, О.А. Петрий, «Электрохимия», Издательство
«Высшая школа», М., 1987 г.
5.
А.Л. Ротинян, К.И. Тихонов, И.А. Шошина, «Теоретическая электрохимия»,
Издательство «Высшая школа», Л., 1981г.
6.
В.В. Скорчелетти, «Теоретическая
электрохимия», Л., 1976г.