Химия и химические технологии
Теоретическая химия
Борщевич Л.В., Жульова
Я.В.
Дніпропетровський національний
університет
КІНЕТИКА ЕЛЕКТРООКИСНЕННЯ КАТІОНІВ
ХРОМУ (ІІІ)
ІЗ ХЛОРАТНИХ РОЗЧИНІВ
Електрохімічне
окиснення катіонів Cr3+ є досить складним
процесом, бо відбувається паралельно з процесами окиснення молекул води та поверхні аноду.
Реакція електроокиснення Хрому (ІІІ) перебігає за високих анодних потенціалів і
супроводжується інтенсивним газовиділенням та окисненням анодного матеріалу, що
значно ускладнює встановлення істинного механізму та кінетики цього процесу. Дослідження зазначеного процесу в стаціонарних
умовах показало, що це складний багатостадійний процес, в якому уповільненими є хімічні взаємодії. В даній
роботі досліджувалась кінетика реакції анодного окиснення катіонів Хрому (ІІІ)
на платиновому електроді в розчинах хлоратної кислоти.
Для отримання інформації відносно природи процесів, які перебігають при електроокисненні катіонів Cr3+, нами
була виміряна серія катодних i,E-кривих в спеціальному режимі. Спочатку після стандартної
підготовки, платиновий електрод заданий відрізок часу поляризувався анодно для
накопичення продуктів електроокиснення катіонів Сr3+. Потім
потенціал розгортався в катодну сторону і реєструвались відповідні хроновольтамперограми.
З метою ідентифікації продукту, який утворюється при електроокисненні
катіонів Cr3+ був проведений
порівняльний аналіз катодних відрізків циклічних поляризаційних кривих,
виміряних в розчинах хлоратної кислоти різного складу: 1)без домішок; 2)в
присутності Cr2О72−;
3)в присутності Cr3+; 4)в присутності
Cr2О72− і Cr3+.
Було встановлено, що в розчинах індивідуальної кислоти в області
Е=0,2÷0,4 В реєструється пік відновлення лабільного кисню (Рис.1). Його висота прямопропорційна часу анодної поляризації, а динаміка росту
ілк характеризується
схильністю системи до насичення.
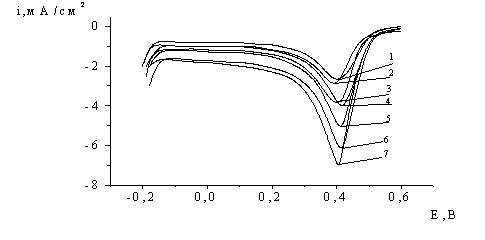
Рис.1. Потенціодинамічні
криві, виміряні на платиновому електроді в 1М HClO4 при різному часі витримки
електроду (с) при потенціалі 1,7 В: 1-0,5;
2-2; 3-5; 4-10; 5-50; 6-100; 7-200.
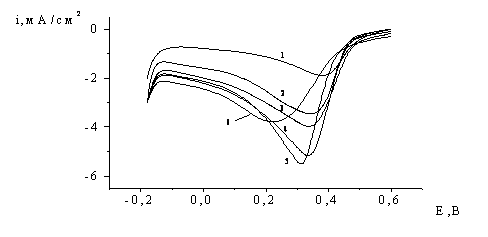
Рис.2. Потенціодинамічні
криві, виміряні на платиновому електроді в розчині 1М НСlО4, 0,0005М СrО3, при різному часі
витримки електроду (с) при потенціалі 1,7 В: 1 – 0,5; 2 – 5; 3 – 10; 4 – 20; 5
– 50; 6 – 100.
Величина критерію Семерано, виміряного для цього піка, виявилась рівною 0,9,
що вказує на його адсорбційну природу. Загальний характер катодних i,E-кривих не змінюється при збільшення потенціалу попередньої
анодної поляризації платинового електрода з 1,7 В до 2,3 В. При введенні в
розчин кислоти домішок CrO3 на і,E-кривій не реєструється змін, які вказували б на участь в
катодній реакції іонів Cr2O72-. За рахунок
адсорбції на аноді біхромат-іонів дещо зменшується пік відновлення лабільного
кисню та відбувається його зсув приблизно на 0,1 В в
катодний бік (рис.2).
Введення в розчин хлоратної кислоти катіонів Cr3+ приводить до
появи нового катодного піку в області Е=-0,05 В (рис. 3). Висота цього
піку закономірно зростає із збільшенням часу попередньої анодної поляризації електрода. Одночасно пік відновлення
лабільного кисню, поступово зменшуючись, деформується і вироджується в невисоку
хвилю, висота якої стає незалежною від часу попередньої анодної поляризації
електрода.

Рис. 3. Потенціодинамічні криві, виміряні на платиновому електроді
в розчині 1М НСlО4,
0,05М Сr(СlО4)3 при різному часі витримки електроду (с) при
потенціалі 1,7 В: 1 – 0,5; 2 – 2; 3 – 5; 4 – 10; 5 – 20; 6 – 50; 7 – 100; 8 –
200.
Ці кінетичні залежності можна пояснити в припущенні, що продукти
електрокиснення катіонів Cr3+ - аніони Cr2O72-, маючи високу поверхневу активність, витісняють з
поверхні платинового електрода “лабільний” кисень, залишаючи лише його інертні
форми. Крім того, оскільки саме “лабільний” кисень здатен активно взаємодіяти з
катіонами Хрому, то введення в розчин кислоти солі тривалентного Хрому теж
повинно закономірно зменшувати кількість цього окисника.
Для виявлення характеру впливу біхромат-іонів на закономірності відновлення
продуктів електроокиснення катіонів Cr3+ нами
були виміряні відповідні вольтамперні криві в розчині 1-молярної хлоратної
кислоти, що містив 0,05 моль/л Cr3+, і в який
додатково препаративно ввели невелику кількість хром (VI) оксиду
(Рис.4).
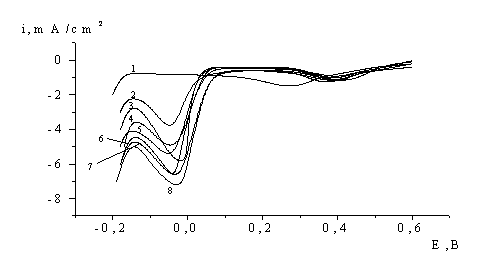
Рис. 4. Потенціодинамічні криві, виміряні на платиновому електроді
в розчині 1М НСlО4,
0,05М Сr(СlО4)3, 0,0005М СrО3, при різному часі
витримки електроду (с) при потенціалі 1,7 В:
1 – 0,5; 2 – 2; 3 – 5; 4 – 10; 5 – 20; 6 – 50; 7 – 100; 8 – 200.
Із рис. 4 (крива 1) видно, що в цьому випадку пік “лабільного” кисню (Е=0,4 В) одразу набуває значення, яке практично співпадає з висотою хвилі (криві 5-7 рис. 3), котра реєструється на насиченому продуктами електроокиснення катіонів Сr3+ електроді. Однак, на відміну від поляризаційних залежностей рис. 3, у вихідному розчині 1М HClO4, 0,05M Cr(ClO4)3, 0,0005М CrO3 на електроді, який попередньо анодно не поляризувався, пік відновлення при Е=-0,05 В повністю відсутній. Обов’язковою умовою появи цього піку є власне попередній електроліз при потенціалах РВК, час якого закономірно збільшує вказаний пік з тенденцією досягнення стану насичення. Таким чином, продукт, який відновлюється при катодному потенціалі порядку 0,05 В, включає до свого складу як аніони Cr2O72- так і первинний продукт окиснення Сr3+, а саме - частки СrO3+ (оксокатіон Хрому). Таким чином можна вважати, що анодне окиснення катіонов хрому (IІІ) перебігає за наступною схемою:
|
H2O
– 2e ®
O + 2H+ |
(1) |
|
Cr3+ + O ® CrO3+ |
(2) |
|
2CrO3+ - 2е- + 5H2O ® Cr2O72- + 10H+ |
(3) |
|
CrO3+ + Cr2O72- + An-® (CrO)(Cr2O7)An |
(4) |