Технические науки
/ Отраслевое машиностроение.
КЛИМЕНКО В. В. , СКРЫПНИК О.
В.
Институт регионального управлления и экономики (г. Кировоград)
Кировоградский национальный технический
университет
ЭКСПЕРИМЕНТАЛЬНАЯ ОЦЕНКА СКОРОСТИ ГИДРАТООБРАЗОВАНИЯ
ДИОКСИДА УГЛЕРОДА
Газовые
гидраты диоксида углерода предлагается применять в самых различных
технологических направлениях – сохранение плодоовощной продукции, приготовление
безалкогольных напитков, разделение смесей технических газов и получение
чистого диоксида углерода [1 - 4]. Для проектирования и расчетов основного
элемента газогидратных установок – кристаллизатора, необходимо иметь данные по
скорости гидратообразования.
Для экспериментального
исследования кинетики процесса образования газовых гидратов диоксида углерода
была спроектирована и изготовлена экспериментальная установка, описание и
принципиальная схема которой приведены в
статье [5].
Исследование
скорости гидратообразования диоксида углерода осуществляется следующим образом.
По трубопроводу в кристаллизатор через штуцер подается дозированное количество
(5 литров) воды или водного раствора и охлаждается до равновесной температуры
гидратообразования. Перед подачей диоксида углерода система, заполненная водой
вакуумировалась. Затем вода или водный раствор насыщались СО2 при
давлении равном равновесному давлению гидратообразования. В таком состоянии
кристаллизатор выдерживался в течение 50…60 минут, при изменении давления из
баллона подавалась порция СО2 с таким условием, чтобы давление газа
вновь достигло равновесного значения. Для начала процесса гидратообразования в
кристаллизаторе создается давление СО2 выше величины давления,
соответствующего равновесной температуре гидратообразования. Стабильность
протекания процесса гидратообразования обеспечивается поддерживанием в
кристаллизаторе постоянного давления СО2. О протекании процесса
гидратообразования судим по изменению массы гидратообразующего газа в объеме
баллона. Изменение массы гидратообразующего газа рассчитывалось по известным
выражениям и контролировалось с помощью электронных весов. Теплота,
выделяющаяся при образовании газовых гидратов, отводится теплоносителем.
Движущая сила
процесса образования гидратов определяется разностью температур между ![]() , равновесной температурой гидратообразования при данном
давлении агента, и
, равновесной температурой гидратообразования при данном
давлении агента, и ![]() температурой суспензии
в кристаллизаторе:
температурой суспензии
в кристаллизаторе:
![]() ,
(1)
,
(1)
Температура ![]() снимается с фазовой
диаграммы при соответствующих давлениях и концентрации раствора. Температура
снимается с фазовой
диаграммы при соответствующих давлениях и концентрации раствора. Температура ![]() измеряется
термометром, термогильза которого помещена непосредственно в объём
перемешиваемой суспензии. В качестве варьируемого параметра при исследовании
процесса гидратообразования принималась
измеряется
термометром, термогильза которого помещена непосредственно в объём
перемешиваемой суспензии. В качестве варьируемого параметра при исследовании
процесса гидратообразования принималась ![]() .
.
К выходным
величинам процесса относятся:
1.
Относительная масса газа, вошедшая в состав
гидратов, равная отношению массы газа, вошедшей в состав гидратов к начальной
массе газа:
![]() (2)
(2)
Величина массы
газа, вошедшая в состав гидратов, определялась из выражения:
![]() (3)
(3)
где ![]() - начальная масса
газа;
- начальная масса
газа;
![]() - масса газа на
текущий момент времени.
- масса газа на
текущий момент времени.
2. Скорость образования гидратов. В ряде работ [6, 7], скорость образования гидратов принимается равной
количеству воды, вошедшей в состав гидратов в единицу времени на единицу объёма
кристаллизатора, занятого суспензией. Такое определение скорости
гидратообразования справедливо в случае барботирования гидратообразующего газа
через объем жидкости. В нашем случае, скорость гидратообразования определяется
дифференциальным уравнением вида:
![]() ,
, ![]() (4)
(4)
где ![]() - площадь поверхности
контакта диоксида углерода с водой.
- площадь поверхности
контакта диоксида углерода с водой.
В процессе перемешивания
жидкости в кристаллизаторе многолопастной турбинной мешалкой, визуально
наблюдалось появление воронки. При этом с достаточной степенью точности можно
принять, что поверхность воронки описывается уравнением параболоида вращения, а
ее площадь поверхности рассчитывалась по методике [8]. Высота воронки определялась визуально по
мерной линейке, закрепленной на смотровом окне кристаллизатора.
Механизм
образования газовых гидратов является весьма сложным. Процесс протекает при
наличии трёх фаз (твёрдой, жидкой и газообразной) и по крайней мере, двух
компонентов, с соответствующими процессами передачи энергии и массы, причём в
нестационарных условиях (кристаллизатор периодического действия). В процессе
проведения экспериментов визуальные наблюдения показали, что переохлажденная
жидкая фаза обладает эффектом светорассеяния, интенсивность которого непрерывно
возрастает и достигает максимума, после чего падает по мере образования газовых
гидратов и осветления раствора. Возникновение эффекта светорассеяния можно
объяснить тем, что в переохлажденной системе, включающей воду и
гидратообразующий агент, содержится большое количество субмикроскопических
зародышей, которые до наступления видимой кристаллизации находятся в
кинетическом равновесии с жидкой фазой. С наступлением кристаллизации
происходит резкое сокращение количества субмикроскопических зародышей за счет
образования кластеров критических размеров (клатратов). Это является
доказательством того, что переохлажденная жидкая фаза представляет собой
гетерогенную систему, а скрытый период кристаллизации означает время, в течение
которого происходит укрупнение частичек дисперсной фазы до потери ими
кинетической устойчивости. Следовательно, индукционное время задержки
зарождения, то есть время, необходимое для образования первого наблюдаемого
гидратного ядра, свидетельствует о существовании коагуляционного механизма
взаимодействия [9].
Экспериментальные
данные по зависимости скорости гидратообразования от степени переохлаждения
приведены на рис.1. Как видно из графика, увеличение степени
переохлаждения приводит к росту скорости гидратообразования.
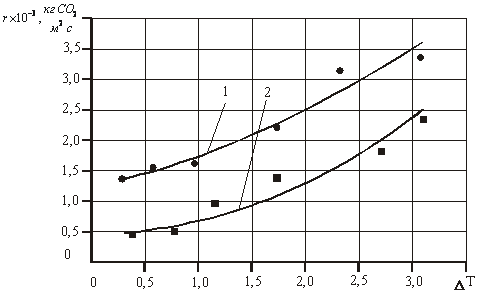
Рис. 2.7 Зависимость скорости образования газовых гидратов от степени
переохлаждения:
1- диоксид углерода; 2 - метан, по сопоставимым данным [10].
Это можно
объяснить тем, что с увеличением разности температур (степени переохлаждения),
существенно уменьшается работа образования субмикроскопических зародышей и,
следовательно, повышается вероятность их возникновения. Кроме того, наряду с
молекулярно-диффузионным ростом, становится возможным рост кристаллов в
результате присоединения к ним целых групп молекул, ориентированных
определенным образом, размеры которых могут колебаться в широком интервале – от
трехмерных зародышей до микроскопических размеров. При этом образуются кластеры
критических размеров, и ускоряется рост клатратов, имеющих размеры больше
критических. Дальнейшее перенасыщение раствора, вследствие образования большого
количества первичных зародышей, приводит к усилению роли коагуляционного
механизма. Молекулярно-коагуляционный механизм роста частиц газовых гидратов
описывается итнегродифференциальным уравнением [9], которое
является достаточно сложным в математическом отношении и для его решения
требуется значительное количество разнородных данных. Поэтому при обобщении
результатов экспериментов основывались на несколько упрощенном механизме
процесса гидратообразования, предложенном А. Vysniauskas A. и Bichnoi P. R. [10]. В соответствии с этим механизмом, для
определения скорости гидратообразования СО2 ![]() использовалась зависимость следующего вида:
использовалась зависимость следующего вида:
![]() (5)
(5)
где ![]() – предэкспоненциальная
константа
– предэкспоненциальная
константа ![]() ;
; ![]() - площадь поверхности
контакта газ – вода,
- площадь поверхности
контакта газ – вода, ![]() ;
; ![]() - энергия активации
образования газовых гидратов,
- энергия активации
образования газовых гидратов, ![]() ;
; ![]() - газовая постоянная,
- газовая постоянная, ![]() ;
; ![]() - температура суспензии в системе, К;
- температура суспензии в системе, К; ![]() - константы;
- константы; ![]() - разность между
равновесной температурой гидратообразования и температурой суспензии в
кристаллизаторе, К;
- разность между
равновесной температурой гидратообразования и температурой суспензии в
кристаллизаторе, К; ![]() - давление в системе,
бар;
- давление в системе,
бар; ![]() - общий порядок реакции по отношению к
давлению в системе.
- общий порядок реакции по отношению к
давлению в системе.
Сопоставление скорости образования газовых гидратов
диоксида углерода и метана показывает, что скорость диоксида углерода
значительно выше (см. рис. 1). По нашему мнению это связано с тем, что
коэффициент диффузии диоксид углерода в воде (водных растворах) выше
коэффициента диффузии метана [11].
Для установок, использующих газгидратную
технологию, весьма важным является интенсификация процессов, в частности
процесса гидратообразования. Известно, что небольшие добавки низших спиртов
(этанола, метанола) существенно увеличивают скорость гидратообразования многих
слаборастворимых в воде гидратообразователей [9, 12, 13].
Нами была поставлена задача экспериментально
изучить влияние добавки этанола к воде на скорость гидратообразования диоксида
углерода. В результате экспериментов авторами установлено что, добавление
этилового спирта до ![]() повышает скорость
образования газовых гидратов диоксида углерода (рис. 2), а при
больших концентрациях этанола, скорость образования газовых гидратов диоксида
углерода уменьшается.
повышает скорость
образования газовых гидратов диоксида углерода (рис. 2), а при
больших концентрациях этанола, скорость образования газовых гидратов диоксида
углерода уменьшается.
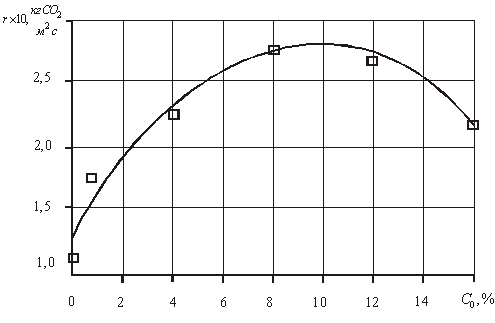
Рис. 2 Зависимость скорости
гидратообразования от концентрации этанола в гидратообразующей
жидкости
Произведя обработку экспериментальных данных
методом наименьших квадратов, получили зависимость скорости гидратообразования
от концентрации этанола следующего вида:
![]() (6)
(6)
где ![]() - скорость
гидратообразования в системе ²Н2О + СО2²
при
- скорость
гидратообразования в системе ²Н2О + СО2²
при ![]() .
.
![]() – объемный процент єтанола в водно-спиртовом растворе.
– объемный процент єтанола в водно-спиртовом растворе.
![]() - коэффициенты,
имеющие размерность скорости гидратообразования;
- коэффициенты,
имеющие размерность скорости гидратообразования;
В водно-спиртовых растворах вода и спирт образуют
сложные равновесные системы, состоящие из водно-спиртовых комплексов —
гидратов, состав которых зависит от количественного соотношения между спиртом и водой в растворе, а также от температуры и
давления [13]. В зависимости от их
состава и термодинамических условий в
водно-спиртовых растворах
происходят различные ассоциативные процессы, благодаря
которым устанавливаются определенные связи между отдельными
молекулами воды и спирта, образуются разнородные комплексы
молекул, а также устанавливается взаимодействие между этими
комплексами и отдельными молекулами воды. Это приводит к тому, что при малых
концентрациях образуются как бы отдельные гидратированные комплексы этанола, с которыми взаимодействует диоксид углерода значительно активнее, чем
с кластерами или отдельными молекулами воды. При больших концентрациях
образуется такое большое количество гидратов спирта, что они начинают
взаимодействовать между собой, затрудняя вследствие этого, свое взаимодействие
с газом. Этим можно объяснить существование оптимальной концентрации этанола (![]() по объему), при которой скорость образования газовых
гидратов диоксида углерода в воде является максимальной.
по объему), при которой скорость образования газовых
гидратов диоксида углерода в воде является максимальной.
ЛИТЕРАТУРА
1. Пименова Е. Ф. Производство и применение
сухого льда, жидкого и газообазного диоксида углерода. – М.: Легкая и пищевая
промышленность, 1982. – 472с,
2.
Патент України № 28955, С12С1/06. Спосіб газування напоїв. / Скрипник О. В., Кошурко В.О. Україна.
Заявлено 29. 12. 99. Опубл. Бюл. №5, 2000.
3.
Патент України №40031, А23L2/26.
Лінія виробництва безалкогольних шипучих напоїв. / Скрипник О. В., Кошурко В.О.
Клименко В.В. Україна. Заявлено 08. 12. 98. Опубл. Бюл. №6, 2001.
4.
Патент України №358500 А, F25J1/00.
Установка для виробництва вуглекислого газу. / Скрипник О. В., Кошурко В.О.
Клименко В.В. Україна. Опубл. Бюл. №3, 2001.
5.
6. Различные области применения холода / под
редакцией Быкова А.
В. – М.: Агропромиздат, 1985. – 272 с.
7. Макогон Ю. Ф. Гидраты природных газов. – М.:
Недра, 1974. – 285с
8. Г. Корн, Т. Корн. Справочник по математике для
научных работников и инженеров. – М.: Наука, 1970. – 719с
9. Клименко В. В., Лопатенко С. В.
Молекулярно-коагуляционный механизм образования газовых гидратов при
аккумулировании холода. // Научно-технический сборник. Тепловые режимы и
охлаждение радиоэлектронной аппаратуры. – 1994. - № 1 – 2. – С. 34 – 39.
10. Vysniauskas
A., Bichnoi P. R. A Kinetic Study of Methane Hydrate Formation // 1Y Canadian
Permalrast Conference.
11. Влияние механических и температурных полей на
процессы генерации и аккумуляции углеводородов. Сборник научных трудов. –
Якутск: ЯФСОАН СССР, 1985. – 150с.
12. Краснов А. А., Клименок Б. В. Влияние добавок
спиртов на скорость образования газовых гидратов. Нефтехимия, 1973, Т 13, №4. –
С. 592 – 595
13. Стабников В. Н. Этиловый спирт. – М.: Пищевая
промышленность, 1976 – 272 с.