Биотехнология мицелия штамма Tyv-2006 Fomitopsis officinalis (Vill.) Bond. et Sing. – продуцента
агарициновой кислоты
Громовых Т.И.*, Айрапетова А.Ю.**, Гаврилин М.В.**, Ковалева Г.К.***
*Московский
государственный университет пищевых производств
**Пятигорская государственная
фармацевтическая академия
***Сибирский государственный
технологический университет
Современное изучение грибов,
как источника биологически активных соединений, микологами и биотехнологами
всего мира началось преимущественно на основе работ с низшими и несовершенными
грибами. В результате многолетних фундаментальных исследований процессов
жизнедеятельности грибов-макромицетов были накоплены данные, показывающие, что
именно макромицеты благодаря большой гетерогенности физиолого-биохимических
свойств могут стать основными объектами
биотехнологии и заменить растения, животных и бактерии (Беккер, 1988; Белова,
2004; Шиврина и др., 1969). Основное число биологически активных веществ
рекомендуют получать из плодовых тел базидиомоцетов. Вполне понятно, что сбор
плодовых тел в природных условиях лимитирован множеством факторов (погодные
условия, сезонность, техногенное загрязнение окружающей среды и т.д.), и,
безусловно, ведет к исчезновению биологического вида. В связи, с чем не может служить
надежной основой для фармакологического производства (Белова, 2004; Псурцева и
др., 2007).
Известно, что биологически активные
вещества высших грибов содержатся не только в базидиомах, но и в вегетативном
мицелии гриба, получаемом путем жидкофазного и/или твердофазного
культивирования. Поэтому важным преимуществом получения биомассы мицелия чистой
культуры с помощью методов биотехнологии являются: экологическая чистота
получаемых препаратов, неограниченная возможность производства, многообразие и
дешевизна сырьевых ресурсов и безотходность производства (Гарибова, 2003;
Краснопольская, 1998, Краснопольская и др., 2007; Феофилова, 2007; Majewsky, 2005; Tripathi
et al, 2008). Однако, биотехнология
производства биологически активных веществ, получаемых из биомассы мицелия высших
базидиомицетов, требует максимальной
интенсификации всех технологических этапов культивирования. Актуальной становится проблема разработки
питательных субстратов и поиска оптимальных условий и стимуляторов их
биологической активности.
Особого внимания заслуживает вид Fomitopsis officinalis (Vill.) Bond. et
Sing. (лиственничная губка),
который является уникальным, благодаря наличию в плодовых телах агарициновой кислоты,
обладающей лекарственными свойствами, широко известными в восточной медицине
уже более двух столетий (Воробьев, 1985; Гаврилин и др., 2006; Ооржак, 2006). Изучению
биологических свойств мицелия гриба F. officinalis посвящено мало работ, что, вероятно, связано с трудностью выделения его в чистую
культуру и, как следствие, отсутствие штаммов этого вида в большинстве
коллекций культур продуцентов.
В России работы с чистой культурой мицелия
гриба F.
officinalis ведутся Т.И.
Громовых с соавторами (Громовых и др., 2009) и М.Л. Сидоренко (Сидоренко 2006; 2007).
Авторы отмечают, что этот вид обладает низкой скоростью роста и высокой
требовательностью к составу питательных субстратов. М.Л. Сидоренко (Сидоренко,
2007) провела исследования по оптимизации
состава питательной среды для глубинного культивирования гриба F. officinalis.
В
результате этих исследований автором была разработана оптимальная
полусинтетическая питательная среда для получения биомассы мицелия этого гриба
глубинным способом.
Практическое использование этого вида
базидиомицета в чистой культуре возможно в нескольких основных аспектах:
производство мицелия для получения плодовых тел; получение биологически
активных и ценных химических веществ агарициновой кислоты и глюканов. Согласно данным
исследований биохимического состава и фармакологических свойств плодовых тел F. officinalis,
проведенным А.Ю. Айрапетовой и М.В. Гаврилиным (2006), количество агарициновой
кислоты в них составляет от 5 до 9 %. По данным авторов Т.И. Громовых и др. (патент
RU
2257222 C17
27.07.2005.), водные экстракты, полученные из мицелия этого штамма, оказывают токсическое
действие в отношении опухолевых клеток асцитной карциномы Эрлиха (АКЭ). В связи с этим, представляется целесообразным проведение исследований
по разработке биотехнологии мицелия штамма Tyv-2006 гриба
Fomitopsis officinalis.
Цель
работы: подобрать питательную
среду для культивирования мицелия штамма Tyv-2006 гриба Fomitopsis officinalis и определить количество
агарициновой кислоты в мицелии.
Методы
исследований
Изучение
культуральных особенностей штамма при различных условиях культивирования
Для определения ростовых признаков исследуемые штамм
культивировали на агаризированных питательных средах следующего состава (г*л-1):
сусло-агар – пивное неохмеленное сусло - 300 мл, агар - 18,0, вода - 600 мл;
сусло-агар с добавлением 1 % лиственничных опилок – пивное неохмеленное сусло -
300 мл, агар – 18,0, лиственничные опилки – 10,0, вода - 600 мл; картофельно
декстрозный агар – отваренный картофель (неочищенный, с белой кожурой) - 250,0,
декстроза - 20,0, агар - 20,0, вода - до 1000 мл; грибной агар – свежие
съедобные грибы - 50,0, крахмал водорастворимый - 5,0, агар - 20,0, вода - до
1000мл.
С целью стандартизации посевов в качестве инокулюма использовали цилиндрические блоки мицелия диаметром 8 мм, вырезанные с помощью пробойника из зоны роста семисуточной культурой штамма. Инкубирование культуры проводили в термостате типа ТС-80 при температуре 25±1 ºС в течение всего срока наблюдения. Каждые сутки роста на твердых питательных средах измеряли диаметр разрастания колоний и наблюдали за их культурально-морфологическими признаками (текстура и форма колоний, пигментация мицелия и резервума, наличие экссудата и др.), плотностью и высотой воздушного мицелия.
Суточную линейную скорость роста (СР) культуры вычисляли по формуле: СР = D-d/2t, где D – диаметр колонии, мм; d – диаметр инокуляционного блока, мм; t – время культивирования, сутки. Ростовой коэффициент (РК) вычисляли по формуле: РК = D-d*h*g/t, где D – диаметр колонии, мм; d – диаметр инокуляционного блока, мм; h – высота колонии, мм; g – плотность колонии, баллов; t – возраст колонии, суток.
При изучении скорости роста мицелия гриба в культуре использовали линейные методы измерения. Замеры проводили через каждые 48 часов культивирования. После чего рассчитывали среднесуточную скорость роста (мм/сут.).
Изучение динамики накопления биомассы мицелия проводили путем стационарного
жидкофазного культивирования продуцента на пивном неохмеленном сусле (4°Б) и
сусле с дополнительным
внесением 1 % лиственничных опилок при температуре 25±1 ºС. В
качестве инокулюма использовали цилиндрические блоки диаметром 8 мм, вырезанные
с помощью пробойника из зоны роста семисуточной культурой соответствующего
штамма. Учет
накопления биомассы проводили
весовым методом через каждые 5 сут в течение 5-40 сут культивирования штамма
Tyv-2006
F. оfficinalis.
Выделение и идентификация агарициновой
кислоты в мицелии гриба Fomitopsis officinalis
Для выделения агарициновой кислоты из мицелия гриба Fomitopsis officinalis около 1.5
г измельченного мицелия до размера
частиц 1.5-2.0 мм помещали в коническую колбу вместимостью 50 мл, заливали 10
мл смеси хлороформ-этанол 1:2 и экстрагировали трижды в течение 3-х часов до
полного истощения сырья, заливая каждый раз мицелий новой порцией хлороформ-этанольной
смесью. Полученное объединенное извлечение
упаривали при температуре 60 ºС до 5 мл и выдерживали в течение 12-ти часов при температуре -4 ºС до
появления осадка. Надосадочную жидкость сливали, а полученный осадок растворяли в 5 мл этилового спирта при нагревании и
снова охлаждали до выпадения осадка. Надосадочную жидкость сливали. Осадок высушивали и взвешивали.
Идентификацию агарициновой кислоты проводили методом тонкослойной хроматографии
(ТСХ), для чего готовили 1% раствор образца в спирте этиловом и наносили на
хроматографическую пластинку «Сорбфил» 10 мкл. Рядом наносили 10 мкл 1%
раствора стандартного образца агарициновой кислоты (SIGMA ALDRICH,
Германия). Полученную хроматограмму помещали в систему растворителей
хлороформ-уксусная кислота-вода (15:1:1).
Детектирование проводили раствором бромкрезолового
зеленого. УФ-спектры 0,05% растворов
выделенного вещества из мицелия и достоверного стандартного образца
агарициновой кислоты в спирте этиловом
были идентичны (Патент 2007100417/15
RU).
Результаты исследований
Главной задачей
предпринятого исследования являлась оценка возможности культивирования мицелия F. officinalis в
искусственных условиях.
Изучение культуральных особенностей штамма Tyv-2006 Fomitopsis officinalis показало, что колонии развиваются медленно на всех изучаемых агаризованных питательных средах. Среднесуточная скорость прироста мицелия гриба на агаризованных питательных средах низкая. Лучшими средами по скорости роста и ростовому коэффициенту продуцента являются сусло-агар без добавления и с добавлением 1 % лиственничных опилок (таблица 1). На средах картофельно-декстрозный агар, грибной агар были самые низкие показатели ростового коэффициента штамма, следовательно их использование для культивирования Tyv-2006 F. оfficinalis нецелесообразно. Не следует вносить в среду сусло лиственничные опилки в количестве более 1 %, так как это ингибирует рост мицелия штамма.
Таблица 1 – Ростовые показатели колоний штамма Tyv-2006 Fomitopsis officinalis на агаризованных
питательных средах
|
Питательная среда |
Среднесуточная скорость роста, мм |
Ростовой коэффициент |
|
Сусло-агар (СА) |
0,94 |
25,6 |
|
СА+1% листв. опилок |
1,06 |
46,5 |
|
СА+3% листв. опилок |
0,69 |
11,5 |
|
Грибной агар |
0,49 |
10,3 |
|
Картофельно-декстрозный агар |
0,34 |
2,1 |
Прирост мицелия штамма после 30 суток культивирования был максимальным на среде сусло с добавлениме 1 % опилок, а как сусло-агаре с добавлением 3 % лиственничных опилок, грибной агар и КДА был незначительным (0,05-0,1 мм/сут) (рисунок 1).
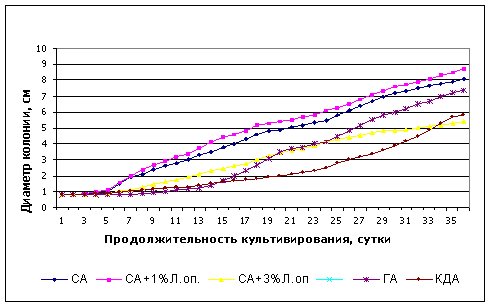
Рисунок 1 – Динамика роста штамма Tyv-2006 Fomitopsis officinalis на агаризованных питательных средах
Оценка ростового коэффициента показала, что штамм гриба Tyv-2006 Fomitopsis officinalis отнесен к медленно растущим.
Достоверно интенсивность развития грибов можно оценить по накоплению биомассы мицелия при выращивании на жидких питательных средах, т.к. на агаризованных питательных средах при равном диаметре колонии значительно отличаются по плотности и высоте. Установлено, что в стационарной культуре штамм образуют мицелиальную пленку белого цвета, представляющую собой плотное сплетение гиф. Динамика накопления биомассы мицелия штамма Tyv-2006 Fomitopsis officinalis на 5-40-е сутки культивирования представлена в таблице 2.
Таблица 2 – Показатели накопления биомассы мицелия штаммом Tyv-2006 Fomitopsis officinalis
|
Время культивиро-вания, сут |
Биомасса (г/л) мицелия штамма Tyv-2006 Fomitopsis officinalis на средах |
|
|
Сусло+ 1 % листвен. опилки |
Сусло |
|
|
5 |
0,84±0,01 |
0,50±0,01 |
|
10 |
2,56±0,02 |
1,56±0,03 |
|
15 |
3,21±0,03 |
1,95±0,02 |
|
20 |
5,07±0,17 |
2,12±0,09 |
|
25 |
6,90±0,28 |
3,48±0,25 |
|
30 |
10,35±0,08* |
4,84±0,11* |
|
35 |
11,19±0,24* |
4,95±0,20* |
|
40 |
11,69±0,13* |
5,22±0,17* |
|
Примечание: «*» - различия недостоверны при последующем культивировании |
||
Как видно из данных таблицы 2, биомасса на среде сусло, содержащей 1 % опилок, выше, чем на сусле без добавления опилок в 2,2 раза. Максимального значения биомасса достигает при культивировании в течение 30 суток. Полученные пленки мицелия хорошо измельчаются в порошок.
Идентификация полученных образцов порошка мицелия, проведенная методом УФ-спектроскопии в сравнении со стандартным образцом агарициновой кислоты (SIGMA ALDRICH, Германия), показала, что УФ-спектры выделенных образцов и стандарта агарициновой кислоты снятые, на регистрирующем приборе идентичны, что подтверждает соответствие стандарту порошка из мицелия (рисунок 2). Содержание агарициновой кислоты в мицелии составило 6,3% по отношению к массе сухого мицелия.
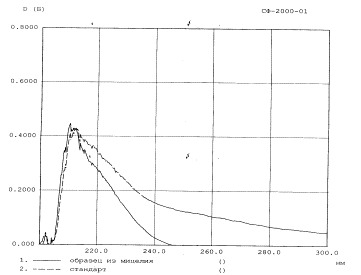
Рисунок 2 – УФ-спектры раствора
порошка, полученного из мицелия гриба Fomitopsis officinalis и стандартного образца агарициновой кислоты
После обработки хроматографических пластинок раствором бромкрезолового зеленого на голубом фоне хроматограммы появляются два желтых пятна агарициновой кислоты (SIGMA ALDRICH, Германия) и образца, полученного из мицелия с Rf около 0,5 , что свидетельствует об идентичности стандарта агарициновой кислоты (SIGMA ALDRICH, Германия) и образца, полученного из вегетативного мицелия лиственничной губки. Следовательно, мицелий Fomitopsis officinalis может быть использован как источник получения агарициновой кислоты как одного из эффективных противомикробных препаратов.
Литература
1. Беккер, З.И. Физиология и биохимия грибов / З.И.
Беккер. – М.: Изд-во МГУ, 1988. – 277 с.
2. Белова, Н.В. Перспективы
использования биологически активных соединений высших базидиомицетов в России
// Н.В. Белова / Микология и фитопатология.
– 2004. – Т. 38, №. 2. – С. 1-4.
3. Воробьев, Г.И. Лесная энциклопедия / Г.И. Воробьев,
Н.А. Анучин, В.Г. Атрохин. – М.: Сов. энциклопедия, 1985. – 563 с.
4. Гаврилин, М.В. Идентификация агарициновой кислоты
методом инфракрасной спектроскопии // М.В. Гаврилин, В.Г. Беликов, А.Ю Айрапетова,
П.А. Цуканова / Вестник ВГУ. Серия: химия, биология, фармация. – 2006. – №. 2.
– С. 231-232.
5. Гарибова, Л.В. Рост и
морфологические признаки мицелия трутовика лакированного Ganoderma lucidum в зависимости от условий
культивирования // Л.В. Гарибова, А.В. Антимонова, Л.А. Завьялова, Л.М.
Краснопольская / Микология и фитопатология.
– 2003.– Т. 37, № 3. – С. 14-19.
6. Громовых, Т.И. Биологические свойства и продуктивность
нового штамма базидиомицета Tyv-2006 Fomitopsis officinalis (Will.) Bond. et Singer // Т.И.
Громовых, Г.К. Ковалева / Вестник КрасГАУ. – Красноярск, 2009. - №1. – С. –
68-75.
7. Краснопольская, Л.М. Грибы
класса Basidiomycetes – источники лекарственных
веществ // Л.М. Краснопольская / Современные проблемы микологии, альгологии и
фитопатологии: сборник статей. М.: МГУ – ИД «Муравей», 1998. – С. 230-232.
8. Краснопольская, Л.М.
Высокоэффективные способы погруженного культивирования ксилотрофных
лекарственных и лекарственно-съедобных видов базидиальных грибов // Л.М.
Краснопольская, А.В. Автономова, М.И. Леонтьева, И.В. Белицкий, Е.Б. Исакова,
В.М. Бухман / Успехи медицинской микологии.
– 2007 – Т. IX. – С. 241-243.
9. Ооржак, У.С. Состав минеральных элементов трутовика лекарственного
в процессе развития // У.С. Ооржак,
В.М. Ушанова, С.М. Репях / Вестник СибГТУ. – 2003. – №1. – С.
76-78.
10.
Патент 2257222 RU, МПК7
A61К35/84. Комплексная
переработка гриба трутовик лекарственный (Fomitopsis officinalis
(Vill.: Fr.) Bond. et Sing) / У.С. Ооржак, В.М. Ушанова, В.И. Канзай. – заявл.
02.07.04 г.; опубл. 27.07.05 г., бюллетень №21.
11.
Патент 2007100417/15
RU. Способ получения агарициновой кислоты / А.Ю. Айрапетова,
П.А. Цуканова, М.В. Гаврилин, Т.А. Шаталова; заявитель
и патентообладатель ГОУ ВПО Росздрава Пятигорская государственная
фармацевтическая академия. – заявл. 09.01.2007; опубл. 10.08.2008 г., бюллетень
№22.
12.
Патент RU 2257222 C17 27.07.2005.
Штамм базидиомицета Fomitopsis Tyv-2006, используемый для получения противоопухолевых
препаратов./ Громовых Т.И., Садыкова
В.С., Ковалева Г. К., Черепанова Л.И., Инжеваткин Е.А. - Заявка 207 20071474
Приоритет от 17.12. 2007. зарег. 10 июля 2009. Опубликовано 10.07.2009 г.
Бюлл.№19.- 7 с.
13. Псурцева, Н.В. Эколого-таксономические предпосылки получения
плодовых тел в культутре макромицетов, представляющих интерес для медицины //
Н.В. Псурцева, А.А. Кияшко, Н.В. Шахова / Успехи
медицинской микологии. – 2007. –
Т. IХ. – С. 254-258.
14. Сидоренко, М.Л. Оптимизация среды для глубинного культивирования мицелия Fomitopsis officinalis // М.Л.
Сидоренко / Успехи медицинской микологии. – 2006. – Т. VII. – С.
304-306.
15. Сидоренко, М.Л. Биотехнология трутовика лекарственного // М.Л. Сидоренко / Мат.
II Междунар. научно-технич. конф. молод. уч. «Актуальные
проблемы технологии живых систем» – Владивосток, 2007. – С. 73-76.
16. Феофилова, Е.П. Новые биотехнологии получения биологически
активных веществ из мицелиальных грибов //
Е.П. Феофилова / Успехи медицинской микологии. – 2007. – Т. IХ. – С. 195-196.
17. Шиврина, А.Н.
Биосинтетическая деятельность высших грибов / А.Н. Шиврина, О.П. Низовская. –
М.-Л.: Наука, 1969. – 241 с.
18. Majewski, T. An attempt to identify to cryptogamic plants in Syreniusz's
herbal // Т. Majewski / Kwart Hist Nauki
Tech., V. 50, №
3-4, 2005. – P. 183-196.
19. Tripathi, M. Selection of white-rot
basidiomycetes for
bioconversion of mustard (Brassica compestris) straw under solid-state
fermentation into energy substrate for rumen microorganism // M. Tripathi, A.
Mishra, A. Misra, S. Vaithiyanathan, R. Prasad, R. Jakhmola / Letters in
Applied Microbiology, V. 46, 2008. – P. 364-370.