Химия и химические технологии/
6.Органическая химия.
К.х.н., доцент Валюк В.Ф.,
студентка ІV курсу
Харченко О. Г.
Уманський державний
педагогічний університет ім. Павла Тичини, природничо-географічний факультет,
кафедра хімії та екології, 20300, Україна, Умань, вул. Садова 2, e-mail: Vvalyuk@mail.ru
МЕТОДИ СИНТЕЗУ ДИЦИКЛОПЕНТАНОПІРИДИНІВ ТА ЇХ АНАЛОГІВ
Люмінофори органічної природи знаходять широке
застосування як сенсибілізатори, активні середовища рідинних лазерів [1-2],
флуоресцентні мітки і зонди у медико-біологічних дослідженнях, де за їх
допомогою вирішують цілий ряд прикладних та наукових задач [3]. Одним з перспективних класів таких
флуоресцентних барвників є гексагідродициклопентано[b,e]піридини. Відносно простий шлях синтезу дає можливість легко
модифікувати структуру дициклопентанопіридинів у потрібному напрямку.
Серед
синтетичних шляхів одержання дициклопентанопіридинів можна виділити три основні
напрямки:
1. Конденсація альдегідів та кетонів з аміаком
та амінами;
2. Високотемпературні реакції
циклопентанону та його похідних з амінами;
3. Використання 1,5-дикетонів в
побудові дициклопентанопіридинової системи.
Розглянемо ці напрямки у зазначеному порядку.
1.
Конденсація альдегідів та
кетонів з аміаком чи амінами
Перші
дослідження реакції конденсації альдегідів та кетонів з аміаком були проведені
Ганчем. А. Е. Чичибабін ще в 1920р. першим використав циклічні кетони у цьому
синтезі [4-6]. Було знайдено, що конденсація може іти різними способами і
залежить як від природи альдегіду, так і від умов реакції.
Так,
конденсація циклічних кетонів та альдегідів з водним аміаком в присутності
невеликої кількості ацетату амонію призводить до утворення дициклопентано[b,e]піридину 1.1 та дициклогексано[b,e]піридину 1.2 [7-8].

V. Balian, R.
Jeyaraman [9-11], досліджуючи конденсації циклічних кетонів, зокрема
циклогексанону та циклогептанону з ароматичними альдегідами в присутності
ацетату амонію виявили, що в даній реакції утворюються азабіциклокетони.
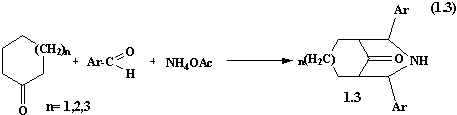
Тими ж
авторами (V. Balian, R. Jeyaraman) було знайдено [12], що за тих же самих умов,
використовуючи однотипні реагенти: циклічний кетон (циклопентанон), ароматичні
альдегіди та ацетат амонію у мольному співвідношенні 2:2:1, можливо отримати
8-арил-диариліден-1,2,3,5,6,7-дициклопентано[b,e]піридини з виходами 15-25%.
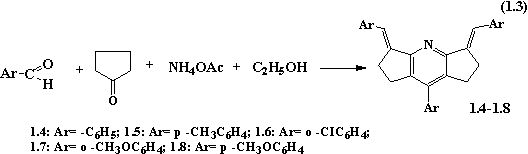
Для отримання
сполук 1.4-1.8 суміш циклопентанону (0.05 моль), ароматичного альдегіду (0.1
моль) і сухого ацетату амонію (0.05 моль) в 50 мл етанолу, нагрівають протягом
3 годин. Після охолодження реакційної маси випадають кристали, які промивають
етером. Вихід 25%. Перекристалізацію проводять з хлороформу чи бензену.
Отримані сполуки мають жовте забарвлення та флуоресценцію в розчинах.
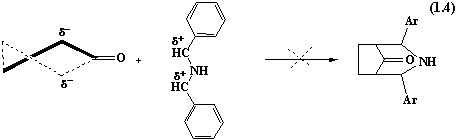
В даній
реакції іде спочатку утворення бензиліденциклопентанону, що утворюється з
циклопентанону і бензальдегіду, який і приймає безпосередню участь у цій
тримолекулярній конденсації з подальшим утворенням 8-арил-диариліден-1,2,3,5,6,7-дициклопентано[b,e] піридину.
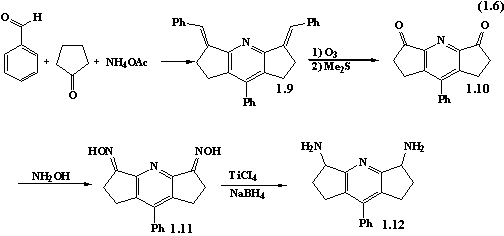
У роботах [13-14] синтез
3,5-дибензиліден-1,2,3,5,6,7-гексагідро-8-фенілдициклопентано[b,e]піридину 1.9 здійснюють за наступною
методикою. Циклопентанон (0.25 моль; 18.4 мл), бензальдегід (0.5 моль; 50.8 мл)
і ацетат амонію (0.25 моль; 19.3 г) розчинений у 250 мл абсолютного етанолу
нагрівають зі зворотнім холодильником 1 годину. Протягом цього часу, розчин
змінює колір від безбарвного до оранжевого. Далі розчин охолоджують на льодяній
бані. В’язку масу, що утворюються, промивають метиленхлоридом. Вихід речовини
(8 г світло-жовтого порошку) становить 15%.
Далі синтезовану сполуку 1.9 піддають озонолізу і
отримують дикетон 1.10. Дикетон 1.10 нагріванням з Na2CO3
і NН2ОН·НСІ в ДMФ перетворюють в оксим 1.11, який без виділення із
реакційної суміші відновлюють сумішшю NaBH4 і TiCI4 в сухому ДMФ з утворенням 1.12.
2.
Високотемпературні
реакції циклопентанону та його похідних з амінами
Конденсацію
альдегідів з аміаком також проводили в газовій фазі, використовуючи
різноманітні каталізатори оксидної природи, наприклад – оксид алюмінію. В
більшості випадків у таких умовах утворювалась суміш численних продуктів
реакції з низькими виходами компонентів.
В роботі [15]
описуються високотемпературні реакції циклопентанону та його похідних з
аліфатичними амінами та аміаком. Наприклад, сполука 1.13 синтезована з виходом
11.5% взаємодією циклопентиламіну (1 моль) і 2-бутиліденциклопентанону (3 моль)
у присутності каталітичної кількості ацетату амонію при температурі 200˚С.
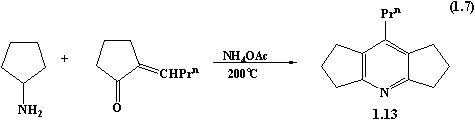
Незначні
кількості 1.13 знайдено в продуктах високотемпературної (300-350˚С)
реакції між еквімолярними кількостями циклопентанону та три-N-бутиламіну.
В патенті [16] описані конденсовані
піридини, що також отримані шляхом високотемпературного синтезу
(250-550˚С), при конденсації відповідних кетонів з аліфатичними
альдегідами та аміаком. Так, в реакції циклопентанону, формальдегіду та NH3
у співвідношенні 100:25:50 при 350˚С утворювався дициклопентано[b,e]піридин 1.14 з виходом 38%.
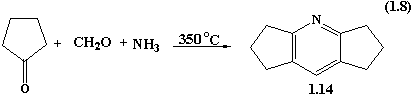
Синтез
дициклопентанопіридинового похідного в дещо м’якших умовах описується в статті
[17]. 2,3:5,6-Ди(триметилен)піридин 1.14 отримують наступним шляхом:
2-амінометиленциклопентанон (0.5г, 4.5 ммоль), циклопентанон (0.38 г, 4.5
ммоль) та ацетат амонію 10 мг нагрівають до 120˚С протягом 12-20 год.
Після цього реакційну масу охолоджують, суміш розтирають з естером і естеровий
розчин висушують над МgSO4. Після фільтрації розчинник випарюють під
вакуумом. Отриману темну олію очищають вакуумною перегонкою. Отримують 0.63 г
білого кристалічного матеріалу, ТПл. 86˚С.
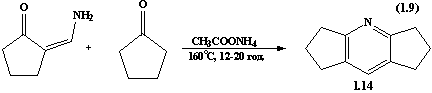
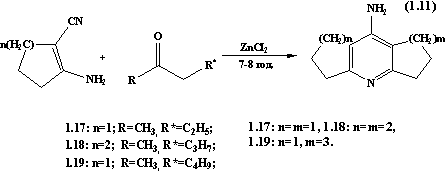
В патенті [18]
описуються сполуки: 1,2,3,5,6,7-гексагідродициклопентано[b,e]піридин-8-амін 1.15
та 1,2,3,4,5,6,7,8-октагідро-9-акридинамін 1.16 яким притаманна нейротропна
активність. Дані сполуки отримують конденсацією 1-аміно-2-ціано-1-циклопентену
з кетонами (n = 1-2) при температурі 160-180 ˚С у суміші бензолу з
поліфосфорною кислотою.
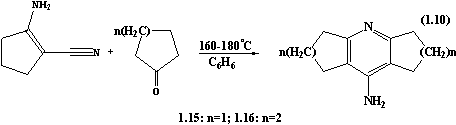
Синтез та
властивості даного класу сполук описано в роботі [19]. Синтез
1,2,3,5,6,7-гексагідродициклопентано[b,e]піридин-8-аміну 1.17,
1,2,3,4,5,6,7,8-октагідро-9-акридинаміну 1.18 та 1,2,3,4,5,7,8,9,10,11-декагідродициклогептано[b,e]піридин-12-аміну
1.19 здійснено взаємодією єнамінонітрилів чи антранілонітрилу з відповідними
кетонами. Синтез проводять наступним чином.
Кип’ятять зі
зворотним холодильником 0.01 моль єнамінонітрилу, 0.02 моль кетону і 1.5 г
безводного хлориду цинку в 25 мл сухого ксилолу протягом 2-8 годин,
охолоджують, ксилольний розчин декантують, смолянистий залишок розтирають в 25
мл 5н КОН, осад фільтрують, промивають водою та гарячим хлороформом, хлороформ
відганяють, осад хроматографують на колонці із силікагелем спочатку в
хлороформі, потім – в системі бензол-абсолютний спирт – амоніак (40:9:1).
Методи
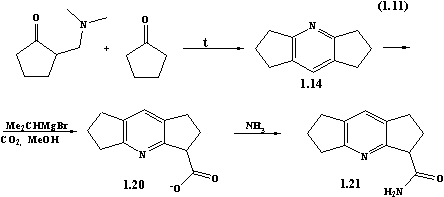
синтезу карбоксильованих та амінованих похідних дициклопентано[b,e]піридинів були запатентовані [20].
Зокрема, реакцією циклізації циклопентанону з
2-(диметиламінометил)циклопентаноном було синтезовано гексагідродициклопентано[b,e]піридини 1.14.
Нагріванням 1.14 з
ізопропілмагній бромідом, метанолом і СО2 отримують
1,2,3,5,6,7-гексагідродициклопентано[b,e]піридин-3-карбоксилат
1.20, дією амоніаку на 1.20 отримують 1,2,3,5,6,7-гексагідродициклопентано[b,e]піридин-3-карбоксамід 1.21.
Використання
1,5-дикетонів у побудові дициклопентанопіридинової системи
Серед
синтетичних методів отримання похідних дициклопентанопіридинів та їх похідних
найбільш загальними, ефективними і широковживаними являються методи, в яких
виходять із 1,5-дикетонів чи сполук, які утворюють ці дикетони в процесі
реакції.
В роботі [21] автори описують
синтез похідних піридину з двома циклопентановими кільцями з використанням d-дикетону, ацетату амонію та оцтової кислоти.
Вихід цільового продукту – 60%.
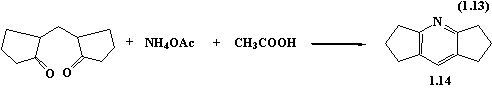
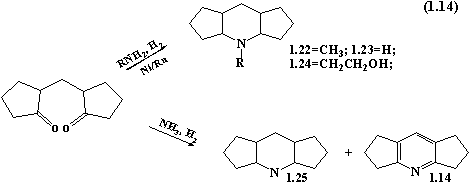
Структури
типу 1.14 були також виділені в реакціях каталітичного відновного амінування
дикетонів. Амінуючими реагентами при цьому були метиламін, етиламін та анілін.
При використанні метиламіну та етиламіну відбувається утворення N-заміщених
дициклопентано[b,e]піперидинів
1.22-1.24. Аналогічний характер мають перетворення дикетонів під дією водню та
аміаку. При цьому утворюється суміш дициклопентано[b,e]піперидину 1.25 та дициклопентано[b,e]піридину 1.14.
Серія робіт Камінського і Тиліченка [22] присвячена
вивченню конденсації 1,5-дикетонів з альдегідами та первинними амінами з
утворенням N-заміщених продуктів: 1,2,3,4,5,6,7,8-октагідродициклопентано[b,e]піридинів
та солей 1,2,3,5,6,7-гексагідродициклопентано[b,e]піридинію.
При вивченні взаємодії 2,2׀ –
метиленциклопентанону з аніліном в 98%-ній оцтовій кислоті було виявлено, що
спочатку утворюється ацетат 4-феніл-1,2,3,5,6,7,7a,8-октагідродициклопентано[b,e]піридинію.
Останній без виділення переводили в 4-феніл-1,2,3,3a,4,5,6,7,8,8a-декагідродициклопентано[b,e]піридин
шляхом розбавлення реакційної суміші водним розчином соди. При додаванні NaClO4
до водного розчину після
відділення сполуки 1.26, отримали перхлорат
4-феніл-1,2,3,5,6,7-гексагідродициклопентано[b,e]піридинію 1.27.
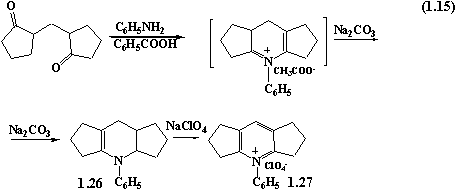
Отримані дані дозволяють стверджувати, що в даному разі спостерігається
диспропорціонування проміжної сполуки – ацетату N-арилпіридинію на відповідні
похідні 1.26 і 1.27.
Також були
отримані N-R-9-Rا – дициклопентанодигідропіридини, які
утворюються в результаті реакції аліциклічних 1,5-дикетонів з первинними
аліфатичними амінами в присутності каталітичних кількостей пара-толуолсульфокислоти. Із первинних амінів використовують
метиламін, етаноламін, бензиламін.
Література:
1.
Lakowicz J.R. Topics
in Fluorescence Spectroscopy. - Plenum Press, New York, 1994. - Vol. 4: Probe
Design and Chemical Sensing (Ed.). – 520 p.
2.
Valeur B. Molecular fluorescence. – Wiley VCH, Weinheim, 2002. – 408 p.
3.
Добрецов Г.Е.
Флуоресцентные зонды в исследовании биологических мембран. - М.: Наука, 1989. – 278 с.
4.
Чичибабин А.Е., Мошкин П.А., Тяжелова Л.С.
Конденсация уксусного альдегида с аммиаком в присутствии окиси алюминия //
ЖРХО. – 1920. – №54. – С. 413-526.
5.
Чичибабин
А.Е., Орочко Д.И. Конденсация альдегидов и циклических кетонов с аммиаком // ЖРХО. – 1930. – №62. – С. 1201-23.
6.
Tchitchibabine A.E. Us syntheses bans la serie de
la pyridine // Bull. soc. chim., France – 1936. – Vol. 5, №3. –
Р. 762-82.
7.
Tchitchibabine A.E. Sur les reactions de condensation des aldehydes et cetones avec
l’ammoniaque en bases pyridiques. Condensation des aldehydes acetique et
crotonique // Bull. soc. chim., France. – 1937. – Vol. 5, №4. – Р. 1826-38.
8.
Tchitchibabine A.E. Sur les reactions de condensation des aldehydes et cetones avec
l’ammoniaque en bases pyridiques. Condensation aves les cetones cycliques // Bull. soc. chim., France. – 1939. – Vol.5, №6. – Р. 522-32.
9.
Baliah V., Jeyaraman
R. Synthesis of some –3-azabicyclo[3.3.1]nonanes // Indian
J. Chem. – 1971. – Vol. 9.
– Р.1020-21.
10.
Baliah V., Jeyaraman R., Usha R. Synthesis of some azabicyclic ketones
// Indian J. Chem. – 1977. – Vol. 15В.
– Р.90-98.
11.
Baliah V., Jeyaraman R. Synthesis of some azabicyclooctene berivatives though a selcetive Hofmanm
degradation of 2,4-diphenil-3-azabicyclo[3.3.1]nonan-5-one // Indian
J. Chem. – 1977. – Vol. 15В. – Р. 791-797.
12.
Baliah V., Jeyaraman R. 8-Aryl-3,5-diarylidene-1,2,6,7-tetrahydrodicyclopenta[b,e]pyridines
by the Condensation of Cyclopentanone with Substituted Benzaldehydes in the
Presence of Ammonium Acetate // Indian
J. Chem. – 1977. – Vol. 15В. – Р.797-799.
13.
Kneeland D.M., Ariga K., Lynch V.M., Huang
Ch.-Yu., and Anslyn E.V. Bis(alkylguanidinium) receptors for phospohodiesters:
effect of counterions, solvent mixtures, and cavity flexibility on complexation
// J. Am. Chem. Soc. – 1993. – Vol. 115, №22. – Р. 10042-10055.
14.
Perreault D.M., Cabell L.A., Anslyn E.V. Using guanidinium
groups for the recognition of RNA and as catalysts for the hydrolysis of RNA
// Bioorganic & Medicinal Chemistry. – 1997. – Vol.5, №6. – P. 1209-1220.
15.
Edgar O.B., Johnson D.H. High-temperature(300-350 ˚C) reactions of cyclopentanone and some of its derivatives with ammonia and aliphatic amines // J. Chem. Soc. – 1958. – Vol. 2. – P. 3925-3939.
16.
Bis(cycloalkeno)pyridines. /Gold D., Scheideanstalt S., Roessler F. / Eur. Pat.(Belg.), (AN 1978:563427), Appl. BE 19776046133, 1978, 11 pp. - Цит. по:
Chem. Abstr. – 1978. – Vol. 131. – 858391.
17.
Thummel R.P., Kohli D.K. Preparation and Properties of Annelated Pyridines // J. Org. Chem. – 1977. – Vol. 42, № 16. – P. 2742-2747.
18.
2,3-Cycloalkano-4-amino-6,7-dihydro-5H-1-pyrindines having neurotropic activity. / Upadysheva A.V., Grigor'eva N.D., Znamenskaya A.P., Lavretskaya E.F., Saratikov A.S., Sarkisyan D.A., Gorshkova V.K. / SU USSR. (C 07 D
221/16, [19752146400]), 30 March 1977, 6
pp. - Цит.
по: Chem. Abstr. – 1977. – Vol. 110. – 552328
19.
Гончаренко С.Б., Каганский М.М., Портнов
Ю.Н., Граник В.Г. Константы ионизации лекарственных препаратов амиридина и
акридина и их аналогов // Химико-Фармацевтический Журнал.
– 1992. – Т. – 26, № 9-10. С. 83-85.
20.
Carboxylic acid salts of tetrahydroquinolines and pyridine derivatives. / Charles A., Curran
A., Ward C. / U.S. 3963722 (CI C 07 D 215/48 [19750638739]), Appl. 19751208, 08 March 1977, 6 pp. - Цит. по:
Chem. Abstr. – 1977. – Vol. 118. – 4011228.
21.
Colonge
J., Dreux J., Delplace H. Etude sur les δ-dicetones bicycliques. Passage
aux composes pyridiniques // Bull. Soc. Chim. Fr. – 1957. – Vol. 8. – P.
447-449.
22.
Каминский В.А., Тиличенко М.Н. О
взаимодействии 2,2׀ – метиленциклопентанона с анилином. //
ЖОХ. – 1969. – T. 5, № 1-2. – С. 186-187.