ПОЛУЧЕНИЕ
МОНОКАЛЬЦИЙФОСФАТА ИЗ ФОСФОРИТОВ КАРАТАУ
Мырзахметова Б.Б., Бестереков
У., Петропавловский И. А.
ЮКГУ
им.М.Ауезова, Казахстан, г.Шымкент ,
РХТУ
им.Д.Менделеева, г.Москва
Резюме
Предложен способ получения
монокальцийфосфата из фосфоритов Каратау жидкофазным методом в условиях рецикла
маточного раствора, изучены состав и удобрительные свойства полученного
продукционного монокальцийфосфата.
Summary
The
of receiving monocalcium phosphate on the basic of phosphorite Karatau by
liquid phase method in condition of recycle the mother solution are suggested,
structure and fertilizing properties of receiving productional monocalcium
phosphate are studied.
Целью исследования явилось выявление возможности
переработки Каратауского фосфатного сырья по рециркуляционной схеме с получением
монокальцийфосфата (МКФ). Исследованы два
вида Каратауского фосфорита месторождений Кокджон и
Коксу (Таблица 1). В основе графических
исследований и расчетов процесса
разложения фосфатного сырья использована известная диаграмма растворимости в системе CaO-P2O5-H2О [2; 3]. В условиях рецикла
маточного раствора и температурно-концентрационных условий,
необходимых для достижения максимального выхода МКФ, графическим путем анализировался максимальный выход Р2О5 в виде Са(Н2РО4)2H2О кристаллической формы.
Таблица 1.Химический
состав образцов фосфорита Каратау
|
№ |
Фосфорит месторождения |
Содержание
основных компонентов, % |
||||||||
|
1. |
Кокджон |
Р2О5 |
СаО |
MgO |
Fe2O3 |
А12О3 |
F |
СО2 |
н.о. |
Н2О |
|
26,13 |
45,28 |
1,84 |
0,68 |
0,97 |
1,93 |
8,78 |
8,43 |
5,96 |
||
|
2. |
Коксу |
21,39 |
35,72 |
0,97 |
0,91 |
0,95 |
2,79 |
3,95 |
28,27 |
5,05 |
Данные таблицы 1 свидетельствуют о
том, что образец фосфорита 1 относится к высококарбонизированному типу,
содержащий карбонаты Са и Mg, а
образец 2- кремнистистому типу
с повышенным содержанием SiO2 (н.о.)
Результаты графических расчетов показали, что норма фосфорной
кислоты составляет 450-500 % избытка от стехиометрии для концентрации 40 % P2O5 при температурах кристаллизации 313 К и разложения 368 К. Отсюда следует вывод, что циркуляционный
фосфорнокислотный метод переработки низкосортного фосфатного сырья 4-5,5-кратным
избытком фосфорной кислоты является целесообразным, и этот процесс с целью научного
обоснования новых возможностей обеспечения наиболее высокой степени
использования исходного сырья, требует дальнейших экспериментальных
исследований, в результате которых определяются оптимальные условия
осуществления отдельных стадий процесса.
Процесс получения МКФ описывается общеизвестными уравнениями реакций [4]:
Ca5(PO4)3F +7H3PO4 + 5H2O = 5Ca(H2PO4)2•Н2О
+ HF
CaСO3 +2H3PO4 = Ca(H2PO4)2•Н2О
+ СО2
(Al,Fe)2О3 +2H3PO4 + H2O = 2(Al,
Fe) PO4•Н2О +2H2O
![]() В результате
графического анализа
[1] и расчета
материальных потоков процесса выявлены соотношения между массами фосфата и фосфорной кислоты поступающего на разложение.
Определены также выход кристаллов Ca(H2PO4)2•Н2О,
состав и масса маточного раствора после их отделения. Полученные
результаты использованы в качестве
основы для постановки экспериментов по исследованию процесса фосфорнокислотного
разложения фосфатного сырья.
В результате
графического анализа
[1] и расчета
материальных потоков процесса выявлены соотношения между массами фосфата и фосфорной кислоты поступающего на разложение.
Определены также выход кристаллов Ca(H2PO4)2•Н2О,
состав и масса маточного раствора после их отделения. Полученные
результаты использованы в качестве
основы для постановки экспериментов по исследованию процесса фосфорнокислотного
разложения фосфатного сырья.
При организации рециркуляционного процесса, как
известно [5], фосфорит подвергается разложению при Т 368К, а затем отделяется
и отмывается от фосфорной кислоты нерастворимый остаток. В дальнейшем система
охлаждается до 313 К, при которой
происходит кристаллизация МКФ. МКФ нейтрализуется аммиаком или оксидом кальция. Маточный раствор
после отделения продукционного монокальцийфосфата, содержащий Ca(H2PO4)2 в пределах
растворимости, возвращается на стадию разложения (рисунок 1).
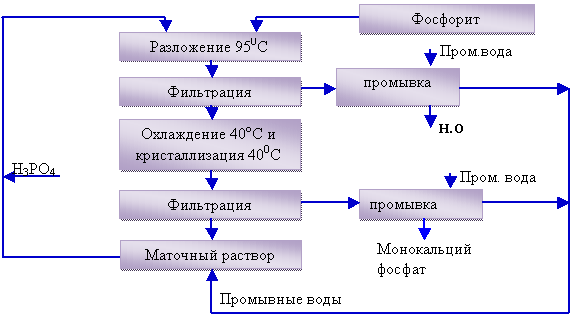
Рисунок 1. Принципиальная схема получения
монокальцийфосфата
В лабораторных условиях был получен МКФ по жидкофазному
методу в условиях рецикла маточного раствора. Химический анализ полученного
продукционного МКФ показал, что продукт достаточно концентрирован основным
веществом. Содержание Р2О5общ
достигает 50-54%. При этом весь Р2О5 находится в
водорастворимой форме, а доля свободной формы Р2О5своб в
виде неотделенной фосфорной кислоты
составляет 18-20%. Для улучшения физических показателей МКФ ее
необходимо нейтрализовать. Электронно-микроскопический
снимок кристаллов МКФ, полученных после отделения от маточного раствора, а
также результаты их элементного
химического анализа, приведены на
рисунке 2 и в таблице 2.

Рисунок 2-Электронно-микроскопический
снимок МКФ
Талица 2-Результаты элементного химического
анализа МКФ
|
Элемент |
Mg |
Al |
P |
S |
Ca |
Fe |
|
Весовой,% |
0,04 |
0,05 |
25,9 |
0,08 |
13,05 |
0,06 |
Из данных рисунка 2 и таблицы 2 следует, что в
продукте фтор отсутствует, а магний, алюминий и железо содержатся в пределах от
0,04-0,06
Были проведены рентгенографический и
ИК-спектральный исследования. По
рентгенограмме и ИК-спектрам МКФ определены его основные составные компоненты.
Таким образом, в
лабораторных условиях установлена возможность получения продукционного
монокальцийфосфата, определены оптимальные параметры всех стадий процесса,
выяснены его удобрительные и кормовые
свойства.
Литература
1.
Мырзахметова Б.Б., Бестереков У.Б., Петропавловский И.А.,
Получение двойного суперфосфата из фосфоритов Кокджон и Коксу жидкофазным
методом. –М.:Объединенный научный журнал (АНП), 2012 №2
2.
Соколовский А.А., Яхонтова Е.Л.,
Применение равновесных диаграмм растворимости в технологии минеральных солей.-
М.: Химия,1982.
3.
Кислотные методы переработки
фосфатного сырья\Л.Яхонтова, И.А. Петропаловский, В.Ф. Кармышов, И.А.
Спиридонова. –М.: Химия, 1988.
4.
Переработка фосфоритов Каратау.//Под
ред. Позина М.Е. и др.-Л.: Химия,1975.-272с
5. Исследование
процесса кристаллизации и фильтрации монокальцийфосфата при циклическом способе
переработки низкосортных фосфоритов Каратау
/ С. О. Ахметова, Ш. М. Молдабеков, А. Б. Ажиметова // Известия вузов.
Химия и химическая технология. - 2003.