Радевич Д.С., Щеколова А.С., Ерошевская Л.А., Квач С.В., Зинченко
А.И.
Институт микробиологии НАН Беларуси,
Минск
ПРОСТОЙ СПОСОБ ОЧИСТКИ
ПЛАЗМИДНОЙ ДНК
Введение. Плазмидная
ДНК (пДНК) широко применяется для вакцинирования и генной терапии.
Использование в качестве лекарственного средства требует разработки эффективных
способов ее очистки от потенциально токсичных или вызывающих иммунный ответ
компонентов бактериальной клетки (геномная ДНК, РНК, белки, эндотоксины).
Несмотря на множество описанных в
литературе методов, универсального способа выделения и очистки пДНК в настоящее
время не существует. Главными недостатками существующих способов очистки
являются трудоемкость, использование дорогостоящих реактивов и сложное
аппаратурное оформление.
Исходя
из вышеизложенного, цель настоящей работы заключалась в разработке простого и
эффективного способа препаративной очистки пДНК.
Объекты и методы исследования.
Конструирование штамма Escherichia coli CpG-KH11, продуцирующего
пДНК, и условия его культивирования описаны нами ранее [1]. Из полученной
биомассы клеток выделяли пДНК методами щелочного и теплового лизиса, а также
методом осмотической экстракции согласно протоколам, описанным в
[2], [3] и [4],
соответственно. На всех этапах выделения и очистки пДНК ее образцы
анализировали с помощью 0,8 % агарозного гель-электрофореза.
Эксперименты
по подбору концентрации цетавлона для очистки пДНК проводились следующим
образом. К «стартовому» раствору, полученному после щелочного лизиса клеток,
добавляли цетавлон, смесь инкубировали при комнатной температуре в
течение 10 мин с последующим центрифугированием при 21 000 g в течение 10 мин. Полученный супернатант отбрасывали,
а осадок суспендировали в растворах различного
состава: дистиллированная вода, 10 мМ TE-буфер (pH 8,0), 0,1 М
КФБ (pH 7,2), 3 M или 5 M хлорид натрия, 3 M ацетат калия, 0,5–3 M ацетат
натрия. После центрифугирования к полученным надосадочным
жидкостям добавляли 1 объем изопропанола. Смеси инкубировали на ледяной бане в
течение 10 мин с последующим центрифугированием. Полученные осадки дважды отмывали
от остатков цетавлона 80 %-ным этанолом и растворяли в TE-буфере.
Частично-очищенный препарат пДНК после обработки цетавлоном
дополнительно очищали с помощью гель-фильтрации. Для этого 5 мл образца,
содержащего около 10 мг пДНК, наносили на колонку (l=30 см, d=3,6 см) со смолой Toyopearl HW-65. Элюцию проводили
дистиллированной водой со скоростью 1 мл/мин.
Результаты и
обсуждение. На
первом этапе пДНК выделяли из клеток E. coli
методами щелочного и теплового лизиса, а также методом осмотической экстракции
(рис.1).
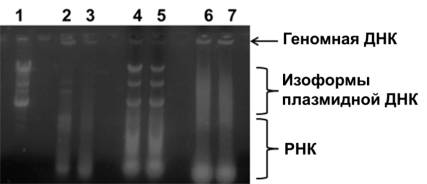
Рис. 1 Электрофореграмма плазмиды,
выделенной с помощью: коммерческих колонок (1); метода осмотической экстракции
(2–3); метода щелочного лизиса (4–5); метода теплового
лизиса (6–7)
Из рис. 1 видно, что метод щелочного
лизиса позволяет эффективно выделять плазмиду из клеток с незначительными
примесями геномной ДНК. Методы теплового лизиса и осмотической экстракции
характеризуются значительно более низким выходом пДНК и
наличием геномной ДНК в полученных препаратах. Примесь РНК присутствовала во
всех образцах, что потребовало дальнейшей очистки пДНК.
Дальнейшую процедуру очистки пДНК
осуществляли с использованием сильного ионного детергента цетавлона, широко
применяемого для разрушения мембран клеток, ДНК-белковых комплексов и отделения
ДНК от полисахаридов. По литературным данным, концентрация цетавлона влияет на
его способность осаждать ДНК из раствора в виде нерастворимых комплексов [5]. Поэтому на данном этапе определяли
оптимальную концентрацию цетавлона,
позволяющую селективно осаждать пДНК. Для этого к раствору пДНК, полученного после щелочного
лизиса клеток, добавляли цетавлон до
конечной концентрации 0,04–0,18 % (рис. 2).
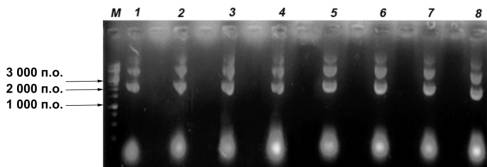
Рис. 2
Электрофореграмма пДНК после осаждения цетавлоном в концентрации 0,04 % (1);
0,06 % (2); 0,08 % (3); 0,1 % (4); 0,12 % (5); 0,14 % (6); 0,16 % (7); 0,18 %
(8).
M – (здесь и далее) фрагменты ДНК известного размера
Дополнительный анализ
полученной электрофореграммы с использованием пакета программ TotalLab TL120
показал, что 0,08 % цетавлон обеспечивает полное осаждение пДНК из раствора с наименьшей примесью
РНК.
На следующем этапе подбирали экстрагирующий раствор для
извлечения пДНК из осадка. В экспериментах использовали растворы, описанные
ранее. Полученные данные позволяют сделать вывод, что растворы с низкой ионной
силой (дистиллированная вода, 10 мМ TE-буфер
(pH 8,0), 100 мМ КФБ (pH 7,2), 0,5 М ацетат натрия) обладают низкой экстрагирующей
способностью в отношении пДНК и РНК. При использовании растворов с высокой
ионной силой (3 M и 5 M хлорид натрия, 3 M ацетат калия, 1 M и 3 M ацетат натрия)
экстрагируется пДНК с примесью РНК, при этом 3 М ацетат калия позволяет экстрагировать
пДНК из осадка с минимальной, по сравнению с другими образцами, примесью РНК
(рис. 3).
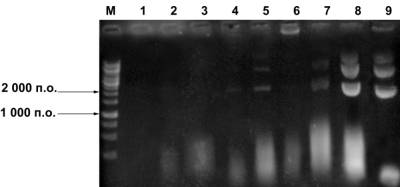
Рис. 3
Электрофореграмма пДНК, полученной при ее экстракции из осадка различными
растворами
1 – дистиллированная
вода; 2 – 10 мМ TE-буфер (pH 8,0); 3 – 100 мМ КФБ (pH 7,2);
4 – 3 M NaCl; 5 – 5 M NaCl; 6 – 0,5 M CH3COONa; 7 –1 M CH3COONa;
8 –3 M CH3COONа; 9 – 3 M CH3COOK
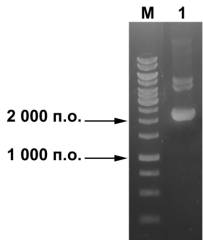
Для окончательной очистки пДНК от
низкомолекулярных примесей использовали гель-фильтрацию на смоле Toyopearl
HW-65. Полученные результаты иллюстрирует рис. 4, из которого следует, что
очищенная плазмида не содержит примесей РНК и геномной ДНК.
Рис. 4 Электрофореграмма пДНК после очистки с помощью
гель-фильтрации (1)
УФ-спектр очищенной плазмиды
соответствовал спектру, характерному для ДНК. Соотношения светопоглощений А260/280=1,9
и А260/230=2,1 также свидетельствовали о высокой чистоте полученной
пДНК [2].
Таким образом, нами предложен простой и
эффективный подход к выделению и очистке пДНК, предусматривающий щелочной лизис
бактериальных клеток, осаждение пДНК 0,08 % раствором цетавлона с последующей
экстракцией 3 М раствором ацетата калия и гель-фильтрацией на смоле Toyopearl
HW-65. Метод отличается от известных аналогов простотой аппаратурного
оформления и использованием более доступных реагентов. Выход пДНК после всех
стадий очистки составил около 60 %.
Литература:
1. Штамм Escherichia coli,
продуцирующий плазмиду, обогащенную иммуностимулирующим CpG-мотивом: пат. 17996 Респ. Беларусь, МПК7 С 12N 1/21 / А.С. Коровашкина, С.В. Квач, А.И.
Зинченко; заявл. 06.09.2011; опубл. 28.02.2014.
2.
Sambrook, J. Molecular cloning: a laboratory manual / J. Sambrook, E. Frittsch,
T. Maniatis. – 2-nd ed. – New York: Cold Spring Harbor Laboratory Press, 1989.
– 2222 p.
3. A
continuous thermal lysis procedure for the large-scale preparation of plasmid
DNA / K. Zhu [et al.] // J. Biotechnol. – 2005. – Vol. 118, N 3. – Р. 257–264.
4. A
one-step miniprep for the isolation of plasmid DNA and lambda phage particles /
G. Lezin [et al.] // PLoS One. – 2011. – Vol. 6, N 8:e23457.
5.
Fractional precipitation of plasmid DNA from lysate by CTAB / R.J. Lander
[et al.] // Biotechnol. Bioeng. – 2002. – Vol. 79, N 7. – P. 776–784.