Биричевская Л.Л., Лузина
Е.Б., Ерошевская Л.А., Зинченко А.И.
Институт микробиологии
НАН Беларуси, Минск
ИССЛЕДОВАНИЕ СООТНОШЕНИЯ АКТИВНОСТЕЙ
РЕАКЦИЙ ГИДРОЛИЗА И ТРАНСФОСФАТИДИЛИРОВАНИЯ, КАТАЛИЗИРУЕМЫХ ФОСФОЛИПАЗОЙ D
STREPTOMYCES NETROPSIS
Трансфосфатидилирование, катализируемое
фосфолипазой D (ФЛД), широко применяется для синтеза разнообразных
фосфолипидов для пищевой и фармацевтической промышленности [1]. Ранее нами в
качестве продуцента ФЛД был отобран штамм Streptomyces
netropsis БИМ В-235 (далее Str. netropsis)
и была продемонстрирована возможность
использования данного фермента для синтеза фосфолипидных производных ряда
противовирусных и противоопухолевых нуклеозидов и серина [2‒4].
Существующая модель каталитического механизма
ферментов ФЛД-суперсемейства постулирует образование ковалентного
фермент-субстратного комплекса ФЛД с фосфолипидом, который на второй стадии
реакции атакуется гидроксильной группой воды или спирта. В результате
образуется фосфатидная кислота (реакция гидролиза) или фосфолипид с новой
полярной головкой (реакция трансфосфатидилирования). Очевидно, что при
осуществлении реакции синтеза фосфолипидов в водных растворах неизбежно
появление побочного продукта – фосфатидной кислоты. Выход целевой реакции
трансфосфатидилирования зависит от конкурентных свойств акцептора (по сравнению
с водой), а также в большой степени от свойств фермента-катализатора. Так, одни
ФЛД катализируют преимущественно реакцию гидролиза, а другие – реакцию синтеза
фосфолипидов [5].
Представляло практический интерес выяснить,
какая из конкурирующих реакций является преобладающей у исследуемой ФЛД Str. netropsis.
Материалы
и методы. Культивирование
стрептомицета проводили, как указано в работе [6]. Источником ФЛД служил
фильтрат культуральной жидкости (КЖ) либо сухой ферментный препарат, полученный
путем фракционирования белков фильтрата КЖ ацетоном (30–60 об.%). Трансферазную активность ФЛД определяли в реакционной смеси (1 мл),
содержащей 10 мМ тимидин или 2-хлор-2'-дезоксиаденозин (лейкладин), 30 мМ фосфатидилхолин (ФХ), 0,2 М натрий-ацетатный буфер (рН 6,0),
0,1 М CaCl2, и необходимое количество ферментного препарата. В
отдельных экспериментах использовали субстраты тимидин и ФХ в концентрации 20
мМ и 40 мМ соответственно. Двухфазная водно-органическая реакционная смесь
содержала 67 об.% хлороформа, 33 об.% водной фазы указанного состава. За ходом
реакции следили, используя ТСХ в системе растворителей хлороформ – метанол –
концентрированный аммиак (14:4:0,15).
Гидролитическую
активность ФЛД определяли, анализируя
накопление фосфатидной кислоты в
реакционной среде. Фосфолипиды разделяли методом ТСХ в системе
растворителей хлороформ – метанол – концентрированный аммиак (15:5:1).
Определение фосфолипидов осуществляли по методу Васьковского.
Активность ФЛД выражали
в ед/мг ферментного препарата. За единицу активности фермента принимали такое
его количество, которое обеспечивало образование 1 нмоль продукта за 1 мин.
Результаты
и обсуждение.
В таблице представлены для сравнения значения трансфосфатидилирующей и
гидролитической активностей исследуемой ФЛД в водно-хлороформной реакционной
смеси и в буферном растворе. При этом реакции проводились при низкой
концентрации нуклеозидов в среде (10 мМ) и трехкратном избытке ФХ.
Как следует из данных таблицы, в двухфазной
системе, даже в отсутствие нуклеозидов в среде, гидролитическая активность ФЛД
в 3–6 раз (в зависимости от активности акцептора) ниже трансфосфатидилирующей.
Присутствие же нуклеозидов снижает гидролитическую активность фермента еще в
1,8 раза (даже в условиях избытка фосфолипида), что указывает на конкурентное
ингибирование гидролитической активности ФЛД нуклеозидами-акцепторами. При
протекании реакции в буфере резко снижается скорость как
трансфосфатидилирования, так и гидролиза, причем даже в этих условиях
гидролитическая активность ФЛД Str. netropsis не превышает
трансфосфатидилирующую.
Таблица 1.
Сравнение
трансфосфатидилирующей и гидролитической активностей ФЛД Str. netropsis
|
Реакция |
Активность ФЛД, ед/мг |
|
|
в водно-хлороформной среде |
в водно-буферной среде |
|
|
Трансфосфатидилирование
(акцептор
– лейкладин) |
6 036±105 |
196±38 |
|
Трансфосфатидилирование
(акцептор
– тимидин) |
3 170±98 |
132±24 |
|
Гидролиз в
отсутствие нуклеозидов |
950±84 |
125±13 |
|
Гидролиз в
присутствие тимидина |
517±51 |
110±14 |
Таким образом, фермент из Str. netropsis может быть отнесен к
группе ФЛД, катализирующих преимущественно реакцию трансфосфатидилирования, что
повышает его ценность как катализатора для биотехнологического синтеза
фосфолипидов.
Далее целесообразно было выяснить, как влияют
другие параметры водно-хлороформной реакционной среды на сопряженную с
трансфосфатидилированием реакцию гидролиза. Было выявлено, что рН- (рН 6) и
температурный (45°С) оптимумы обеих реакций совпадают. Катионы Ca2+ также оказывают
стимулирующее действие на гидролитическую активность ФЛД Str. netropsis.
Однако было замечено, что при полном отсутствии ионов Ca2+, реакция
трансфосфатидилирования замедляется, тогда как продукт гидролиза – фосфатидная
кислота – вовсе не обнаруживается в реакционной среде (см. рис. 1).
Следовательно, для того чтобы избежать образования побочного продукта (в случае
достаточно активных акцепторных соединений) для проведения реакции
трансфосфатидилирования, следует использовать реакционную среду, не содержащую
ионов Ca2+.


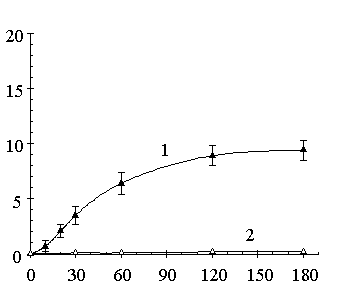 00
00
Рисунок 1 – Динамика накопления фосфатидилтимидина (1) и фосфатидной кислоты (2) в
реакционной смеси в отсутствие ионов Са2+ (А) и в присутствии ионов
Са2+ в концентрации 100 мМ (Б).
По оси ординат: С –
концентрация фосфолипидов в реакционной смеси
Необходимо отметить, что на выход продукта
реакции трансфосфатидилирования может влиять не только гидролиз исходного
субстрата (ФХ), но и гидролиз вновь синтезированного фосфолипида. Анализируя
динамику накопления фосфатидилтимидина в среде, стоит отметить, что после
максимального накопления целевого продукта (выхода кривой на плато), его
количество в среде не уменьшается на протяжении длительного времени. Подобная
зависимость характерна и для синтеза других фосфатидилнуклеозидов, то есть
можно говорить о том, что фосфатидилнуклеозиды не гидролизуются или слабо
гидролизуются ФЛД Str.netropsis. Это
обстоятельство имеет положительное значение при использовании фермента в
качестве биокатализатора для синтеза фармакологически ценных фосфолипидных
производных нуклеозидов.
Литература:
1. Damnjanovic J., Iwasaki Y. Phospholipase
D as a catalyst: application in phospholipid synthesis, molecular structure and protein engineering // J. Biosci. Bioeng. 2013. Vol. 116, N 3. P. 271–280.
2. Биричевская Л.Л.,
Ерошевская Л.А., Кисель М.А., Зинченко А.И. Использование фосфолипазы D
нового микробного штамма-продуцента для синтеза фосфолипидных производных
модифицированных нуклеозидов // Доклады
Нац. акад. наук Беларуси. 2006. Т. 50, № 4. С. 68–71.
3.
Birichevskaya L.L.,
Titovich O.I., Kisel M.A., Zinchenko A.I. Application of Streptomyces netropsis phospholipase D for synthesis of
phosphatidylserine // Biotechnology,
Biodegradation, Water and Foodstuffs / Eds. G.E. Zaikov, L.P. Krylova. New York: Nova Science
Publishers, Inc., 2009. Р. 65–71.
4.
Биричевская Л.Л.,
Хайкина Д.Б., Квач С.В. и др. Синтез 5' фосфатидилрибавирина с
использованием микробной фосфолипазы D // Mater. VII Miedzynarod. konf.
“Naukowa przestrzen Europy-2011”. Przemysl. 2011. V. 21. P. 54–57.
5.
Nakajima J. T. Nakashima, Y.
Shima et al. A facile transphosphatidylation reaction using a culture
supernatant of Actinomycetes directly
as a phospholipase D catalyst with a chelating agent // Biotech. Bioeng. 1994.
Vol. 44, N l. P. 1193–1198.
6. Биричевская Л.Л.,
Зинченко А.И. Влияние условий культивирования на продуцирование фосфолипазы D
при глубинном культивировании Streptomyces netropsis БИМ В-235 // Микробные
биотехнологии: фундаментальные и прикладные аспекты:
сб. науч. тр. / Изд. И.П. Логинов. Редкол.: Э.И. Коломиец [и др.]. Минск. 2007.
Т. 1. С. 38–48.