Рымко А.Н., Щеколова А.С., Квач А.С.,
Зинченко А.И.
Институт микробиологии НАН Беларуси, Минск
ОПТИМИЗАЦИЯ ЭКСПРЕССИИ РЕКОМБИНАНТНОЙ
ДЕЗОКСИНУКЛЕОЗДИДМОНОФОСФАТКИНАЗЫ
БАКТЕРИОФАГА Т5 В КЛЕТКАХ ESCHERICHIA COLI
Дезоксинуклеозидмонофосфаткиназа
(КФ 2.7.4.13, дНМФ-киназа), продуцируемая бактериофагом Т5, катализирует (в
отличие от всех известных дНМФ-киназ) фосфорилирование всех четырех природных
2′-дезоксинуклеозид-5′-монофосфатов до соответствующих
2′-дезоксинуклеозид-5′-дифосфатов [1]. Широкая субстратная
специфичность этого фермента открывает возможность его использования в качестве
одного из ферментов для получения
2′-дезоксинуклеозид-5′-трифосфатов, пригодных для постановки ПЦР
[2].
Ранее нами создан штамм Escherichia coli pdnkТ5, продуцирующий дНМФ-киназу
бактериофага Т5 [3]. Целью настоящей работы была оптимизация условий экспрессии
рекомбинантной дНМФ-киназы.
Объекты и методы исследования. Для культивирования клеток E. coli pdnkТ5 использовали среду LB с добавлением
канамицина до конечной концентрации 100 мкг/мл.
На первом этапе исследования
была проверена зависимость уровня продукции фермента от концентрации клеток в
момент индукции. Для этого в культуральную жидкость (КЖ) вносили
изопропил-β-D-тиогалактопиранозид
(ИПТГ) до конечной концентрации 1 ммоль/л при различных значениях оптической
плотности клеток (от 0,6 до 3 о.е.; λ=600 нм). Анализ активности фермента
проводили через 3 ч после внесения индуктора.
На следующем этапе настоящего
исследования проверяли влияние температуры культивирования на продуцирующую
способность полученного штамма. Клетки выращивали в условиях, описанных выше,
индукцию синтеза белка осуществляли при температурах от 27 до 42 оС.
Далее изучали зависимость
накопления целевого фермента от продолжительности инкубации штамма-продуцента
после внесения индуктора (1–5 ч).
На заключительном этапе
оптимизации экспрессии дНМФ-киназы изучали влияние индуктора (ИПТГ, лактоза) и
его концентрации на уровень продукции целевого белка. Исследования проводили в
условиях культивирования, подобранных в предыдущих экспериментах.
Цифровые данные,
представленные в работе, являются усредненными величинами 3–4 определений с
доверительным интервалом для 95% уровня вероятности.
Результаты и обсуждение.
При оптимизации экспрессии
дНМФ-киназы изменяли следующие параметры культивирования: концентрацию клеток
на момент внесении индуктора, температуру, время культивирования после внесения
индуктора, вид индуктора и его концентрацию. Полученные данные представлены на
рис. 1.
Как видно из рис. 1 А–В, оптимальными
параметрами индукции синтеза дНМФ-киназы штаммом E. coli pdnkТ5 являются: оптическая плотность клеток
на момент индукции 1,5–2 о.е., температура 32 оС, время
культивирования 3–4 ч после внесения индуктора.
На заключительной стадии оптимизации
экспрессии дНМФ-киназы установлено, что использование 0,2 % лактозы в качестве
индуктора экспрессии гена дНМФ-киназы позволяет получать до 22 700 ед
этого фермента из 1 л КЖ, что вполне сопоставимо с уровнем продукции данного
белка при использовании ИПТГ в оптимальной концентрации – 0,5 мМ (27 000 ед/л
КЖ, рис. 1 Г–Д). Принимая во внимание тот факт, что
лактоза является доступным индуктором, ее использование является более
целесообразным при наработке дНМФ-киназы в препаративных количествах, чем
использование ИПТГ.
Таким образом, нами
изучены параметры, влияющие на уровень продукции дНМФ-киназы бактериофага Т5 рекомбинантным штаммом E. coli pdnkT5. Установлено, что наиболее оптимальными условиями
для индукции синтеза фермента являются: температура 32 оС,
оптическая плотность (λ=600 нм) КЖ
1,5 о.е., концентрация лактозы 0,2 %. Выход дНМФ-киназы в этих условиях
составляет 22 700 ед/л КЖ, что более чем в 2 раза превышает лучший
результат, описанный в литературе [4].
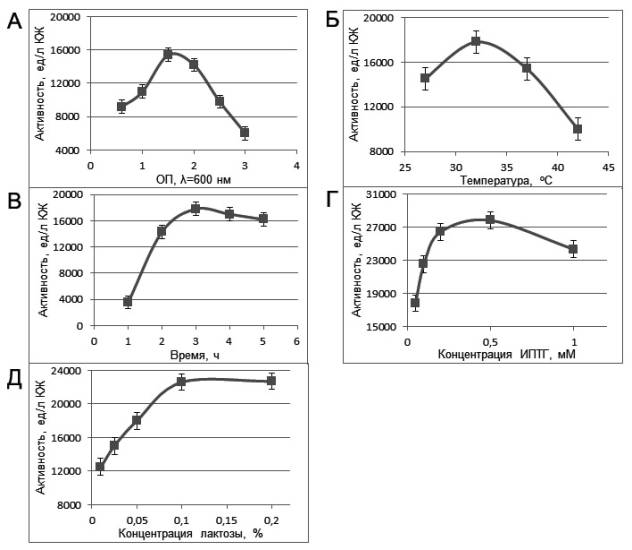
Рис. 1 Зависимость продукции дНМФ-киназы штаммом E. coli pdnkТ5 от стадии роста рекомбинантных клеток
(А), температуры культивирования (Б), продолжительности культивирования после
внесения индуктора (В), концентрации ИПТГ (Г), концентрации лактозы (Д)
Литература:
1. Bessman, M. J. Purification and properties of the deoxynucleotide
kinase induced by bacteriophage T5 / M.J. Bessman, S.T. Herriott, M.J. Van
Bibber Orr // J. Biol. Chem. – 1964. – Vol. 240, N 1. – P. 439–445.
2. Субстратная специфичность дезоксирибонклеозидмонофосфат-киназы
бактериофага Т5 и ее использование для синтеза [α-32P]d/rNTP / А.Ю. Скоблов [и др.] // Биоорганическая химия. – 2009. – Том
35, N 6. – C. 816–821.
3. Создание штамма Escherichia coli – суперпродуцента дезокси-нуклеозидмонофосфаткиназы бактериофага
T5 / А.Н. Рымко [и
др.] // Молодежь в науке – 2012: приложение к журналу «Весцi НАН Беларусi», сер. бiял. навук. – 2012. – № 4. – С. 67–71.
4. Identification,
cloning, and expression of bacteriophage T5 dnk gene encoding a broad
specificity deoxyribonucleoside monophosphate kinase (EC 2.7.4.13) / G.V.
Mikoulinskaia [et al.] // Protein Expr. Purif. – 2004. – Vol. 33, N 2. – P.
166–175.