Магистрантка Ж.Ж. Касимова, к.х.н. Ф.М. Канапиева
Казахский национальный университет им.
аль-Фараби
050038, Алматы, пр. аль-Фараби, 71
КАРБОКСИЛИРОВАНИЕ
ГИДРОКСИАРЕНОВ ЩЕЛОЧНЫМИ СОЛЯМИ ЭТИЛУГОЛЬНОЙ КИСЛОТЫ
Использование
диоксида углерода в качестве источника углерода для органического синтеза
является важной проблемой современной органической химии и нефтехимии.
Утилизация диоксида углерода в химическом синтезе имеет также большое
природоохранное значение, т.к. является одним из путей снижения выбросов СО2,
главного компонента парниковых газов, в атмосферу [1].
В
промышленном масштабе на настоящий момент осуществлены лишь два процесса на
основе СО2: синтез мочевины (карбамида) и салициловой кислоты. Молекула
диоксида углерода обладает низкой реакционной способностью, поэтому подавляющее
большинство реакций с его участием протекает лишь в определенных условиях: при
активации комплексами металлов, применении катализаторов, в жестких условиях проведения
процесса и др. В то же время некоторые простейшие производные диоксида углерода
достаточно активны. В частности, представляют интерес синтезы на основе
металлических солей моноалкилугольных кислот – металлалкилкарбонатов. Последние
легко синтезируются взаимодействием СО2 с алкоголятами металлов.
Гидроксиароматические кислоты находят широкое практическое
применение. Салициловая кислота и ее производные используются в качестве
фармацевтических препаратов [2, 3], п-гидроксибензойная кислота применяется
для получения полимерных материалов и жидкокристаллических полиэфиров [4], ариламиды 2-гидрокси-3-нафтойной кислоты – основа для получения красителей для холодного крашения волокон [5].
Сообщение о возможности синтеза
гидроксибензойных кислот карбоксилированием фенола щелочными солями
алкилугольных кислот впервые появилось в 1958 г. [6]. Позже появилось несколько
работ японских исследователей по
применению щелочных солей алкилугольных кислот для карбоксилирования
гидроксиаренов [7].
Нами исследовано карбоксилирование
оксиаренов (фенола и нафтолов) натрий- и калийалкилкарбонатами в гетерогенных условиях без применения растворителей.
Показано, что
при проведении реакции фенола c натрийэтилкарбонатом в воздушной среде выход
салициловой кислоты не превышает 23-26%; в тех же условиях, но в среде инертных газов (аргон, диоксид углерода) удается повысить выход салициловой
кислоты до 80-86%.
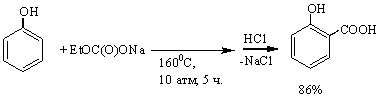
На ход реакции карбоксилирования сильно
влияет температура. При увеличении температуры с 140 до 1600С (РCO2 = 10
атм; τ = 3-5 ч; [фенол] : [натрийэтилкарбонат]=1:1,2) выход салициловой
кислоты увеличивается с 3 до 65%. Однако, дальнейшее увеличение температуры
снижает выход этого продукта (до 45% при 1950С). При этом
установлено, что в интервале 140-1950С виде примеси наблюдается
образование п-гидроксибензойной
кислоты (обнаруживается бумажной хроматографией). Интересно отметить, что при
дальнейшем повышении температуры до 2200С в продуктах резко
увеличивается содержание п-гидроксибензойной
кислоты (17%) и одновременно повышается выход салициловой кислоты (70%); общий
выход о- и п-гидроксибензойных кислот
при температуре 2000С составляет 87%.
Исследовано карбоксилирование фенола калийэтилкарбонатом.
Установлено, что в зависимости от условий проведения реакции образуются
салициловая или п-оксибензойная кислоты. Давление газовой среды (диоксида
углерода) проведения реакции (Т=2150С,
τ = 7 ч (6 ч подъема до 2150С + 1 ч выдержки при этой температуре); [фенол]:[калийэтилкарбонат]=1:1,1) оказывает существенное влияние на выход п-гидроксибензойной кислоты; оптимальным
давлением газовой среды является 25 атм.
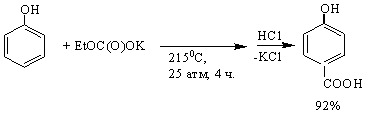
В тех же условиях изучено влияние
температуры (от 130 до 2200С) на ход протекания реакции
карбоксилирования фенола калийэтилкарбонатом при давлении СО2 25
атм. Карбоксилирование при температурах ниже 2000С протекает с
образованием салициловой кислоты. Наибольший выход (78%) салициловой кислоты
наблюдается при 1800С. При дальнейшем увеличении температуры до 1950С
выход салициловой кислоты снижается до 45%, при этом одновременно плавно
увеличивается выход п-гидроксибензойной
кислоты до 20%. Последующее увеличение температуры приводит к образованию лишь п-гидроксибензойной кислоты, максимальный
выход которой (92%) наблюдается при температуре 2150С; дальнейший рост
температуры снижает выход п-гидроксибензойной
кислоты, по-видимому, из-за возможной реакции декарбоксилирования.
Изучено карбоксилирование α-
и β- нафтолов натрийэтилкарбонатом. Найдено, что карбоксилирование ![]() α-нафтола натрийэтилкарбонатом в зависимости от условий
проведения реакции (природа газовой среды, температура) протекает
региоселективно в положения 2 или 4. В
воздушной среде (Pвоздух =1,2-1,4
атм) реакция протекает в положение 2 с образованием лишь 1-гидрокси-2-нафтойной
кислоты. Зависимость выхода продукта от
температуры имеет экстремальный характер
с максимальным выходом при 1600С. Наиболее оптимальная
продолжительность реакции 5 ч (4 ч
подъема температуры до 1600С и выдержка при этой температуре 1 ч).
Дальнейшее увеличение продолжительности реакции приводит к резкому уменьшению
выхода продукта. При оптимальных
условиях проведения процесса (Pвоздух = 1,2–1,4 атм, Т=1600С,
τ =5 ч.) выход 1-гидрокси-2-нафтойной кислоты составляет 74,5% (93,1% в расчете на вступивший в реакцию
α-нафтол).
α-нафтола натрийэтилкарбонатом в зависимости от условий
проведения реакции (природа газовой среды, температура) протекает
региоселективно в положения 2 или 4. В
воздушной среде (Pвоздух =1,2-1,4
атм) реакция протекает в положение 2 с образованием лишь 1-гидрокси-2-нафтойной
кислоты. Зависимость выхода продукта от
температуры имеет экстремальный характер
с максимальным выходом при 1600С. Наиболее оптимальная
продолжительность реакции 5 ч (4 ч
подъема температуры до 1600С и выдержка при этой температуре 1 ч).
Дальнейшее увеличение продолжительности реакции приводит к резкому уменьшению
выхода продукта. При оптимальных
условиях проведения процесса (Pвоздух = 1,2–1,4 атм, Т=1600С,
τ =5 ч.) выход 1-гидрокси-2-нафтойной кислоты составляет 74,5% (93,1% в расчете на вступивший в реакцию
α-нафтол).
В отличие от α-нафтола,
карбоксилирование β-нафтола натрийэтилкарбонатом в среде диоксида
углерода, аргона и в воздушной среде при 110-2300С идёт в положение
3 с образованием 2-гидрокси-3-нафтойной кислоты. Наиболее оптимальной газовой
средой проведения реакции является диоксид углерода. В найденных оптимальных условиях
проведения процесса (РСО2=100 атм, Т=1900С, τ = 5 ч.) выход 2-гидрокси-3-нафтойной
кислоты составляет 38,3% % (91,4% в расчете на вступивший в реакцию
β-нафтол).
Список литературы
1.
Carbon dioxide chemistry: Environmental issues. Paul J., Pradier C.M.,
Eds., Cambridge: Royal Soc. Chem.
1994. 402 p.
2.
Мелентьева Г.А.
Фармацевтическая химия. Т.1. М.: Медицина, 1979. С.277-287.
3.
Машковский М.Д.
Лекарственные средства. 10-изд. М.:Медицина. 1987. Т.1.С.187-194; Т.
2.С.320-322.
4.
Toshinobu S., Makiko
I., Hitoshi
S., Tadakiro
W., Tokio
I., Akinori
M. Патент № 373619 (Европ.) // ИСМ.1991. Вып. 41. №7.
С.18.
5.
Доналдсон Н. Химия и
технология соединений нафталинового ряда. Пер. с англ. М.: ГНТИХЛ, 1963. 655 с.
6.
Jones I.J. // Chem. and Ind. 1958. P. 228.
7.
Hirao I., Kondo T., Kito T. //Kogyo Kagaku Zasshi (Japanese). 1969. V. 72, № 3.
P. 692.