Дроздов А.Л.1, 2. Черная
В.И.2
1 Директор НИИ медико-биологических проблем ГУ
«Днепропетровская медицинская академия МЗ Украины» ул. Дзержинского, 9, г. Днепропетровск, 49044, Украина; 2 Днепропетровский государственный аграрно-экономический
университет ул. Ворошилова, 25, г. Днепропетровск, 49600, Украина
Ультраструктурные исследования состояния секреторного аппарата миокарда
Большой интерес исследователей к изучению предсердного
миокарда у различных биологических объектов был обусловлен обнаруженными специфическими
(секреторными) предсердными гранулами, впервые описанными в публикации Kisch
(1956). Активное накопление сведений о локализации, природе и биологической
роли специфических гранул [1] привело к тому, что все сопоставимые по структуре
саркоплазматические образования стали разделять на 4 основных типа - A, B, C и
D. Было показано, в частности, что С-гранулы по своим ультраструктурным и
гистохимическим характеристикам соответствуют лизосомам; собственно
специфические предсердные гранулы представлены типами A, B и D. Гистохимические
исследования позволили выяснить, что предсердные гранулы в значительной степени
обогащены гликопротеинами, дерматансульфатом, белками и полипептидами. При этом
активность кислой фосфатазы, которая является маркером лизосом, для специфических
гранул оказалась весьма не характерной. С помощью ультраструктурной
авторадиографии было изучено накопление в специфических гранулах
предшественников белкового синтеза - 3Н-лейцина и 14С-лейцина,
а также углеводного синтеза - 3Н-фукозы. Результаты этих
исследований показали, что по своему происхождению предсердные гранулы
неразрывно связаны с аппаратом Гольджи. В опытах Saetersdal с сотрудниками
(1979) было показано, что стимуляция гиперплазии пластинчатого аппарата
изопротеренолом обусловливала ускоренное накопление специфических предсердных
гранул в саркоплазме кардиомиоцитов. Детальное исследование гистохимических и
онтогенетических особенностей комплекса Гольджи позволило предположить, что
сложная структура данной органеллы способствует тонкой регуляции синтетических
внутриклеточных процессов. В обзоре Rotman с соавторами (1987) проведен анализ
общебиологических закономерностей в осуществлении мембранного транспорта, при
котором центральное место принадлежит комплексу Гольджи (включающему 3 разновидности
цистерн).При изучении реакций специфических предсердных гранул на введение
различных фармакологических и токсических агентов был получен большой объем
сведений, которые зачастую оказывались противоречивыми или нестабильно
воспроизводимыми. Несмотря на
многочисленность сведений о неоднородности секреторных предсердных гранул, о
неодинаковом распределении их в отдельных сократительных клетках и тканевых
участках миокарда в составе предсердной стенки, сегодня мы еще не можем сделать
определенного и однозначного заключения о соотношении между типами
специфических гранул в зрелом и развивающемся сердце, а также о проявлениях
секреторной функции кардиомиоцитов в зависимости от их топологических особенностей.
В нашем исследовании при ультраструктурном
исследовании миокарда крыс обнаруживались выраженные различия желудочкового и
предсердного отделов сердца по характеру секреторной активности кардиомиоцитов [2].
В миокарде предсердий у изученных объектов стабильно выявлялись специфические
секреторные гранулы. В настоящее время отчетливо установлено, что указанные
предсердные гранулы содержат белковые молекулы натрийуретического фактора[3].
На фоне слабо ориентированных миофибрилл в нашем исследовании определялись
различные конфигурации специфических гранул, которые выраженно варьировали по
размерам и электронной плотности (рис. 1). В соответствии с распространенным
разделением пердсердных гранул на A-, B- и D-типы, обнаруживаемые нами различия
являются характерной особенностью секреторного аппарата предсердных
кардиомиоцитов. Учитывая, что натрийуретический фактор является главным компонентом
специфических гранул, логично представить существование ультраструктурных различий
между ними как результат определенной смены фаз поведения гранул в саркоплазме
клеток, но не как фиксированный гетерогенитет по химическому составу. На
основании данных ультраструктурного исследования серийных срезов миокарда нам
не удалось выявить существования определенных четко разграниченных типов
секреторных гранул по их диаметру или электронной плотности: широкое
варьирование указанных характеристик не имело дискретного характера. Тем не
менее, нами обнаружен чрезвычайно важный качественный признак, позволяющий
отчетливо разделить всю популяцию специфических гранул на 2 субпопуляции..
А.
Б
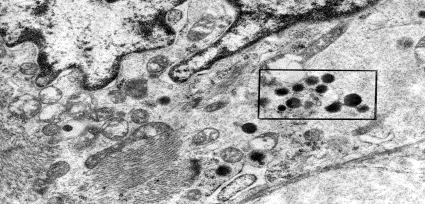
Рис. 1. А – участок сократительного кардиомиоцита в миокарде правого
предсердия крысы контрольной группы. Ув.: ×6000.
Б –
участок саркоплазмы, обозначенный рамкой на рисунке 79-А. Ув.: ×28000.
Стрелками обозначены „тени” безмембранных гранул.
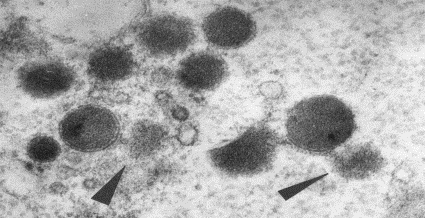
Заключался этот признак в том,
что определенное количество специфических предсердных гранул имело четко
выраженное мембранное окружение (рис. 1-Б); остальные гранулы были лишены
мембраны и имели "размытую" периферию; переходные формы (с частично
сохраненными мембранами) обнаруживались крайне редко
Содержимое мембранных гранул представляло
собой мало структурированное осмиофильное вещество, которое равномерно
распределялось в ограниченном мембраной пространстве гранул или, реже, имело
незначительные уплотнения. Диаметр указанных гранул варьировал от 120 до 250 нм
и составлял в среднем 212±50 нм. Безмембранные специфические гранулы в еще
большей степени, чем мембранные, варьировали по размерам (от 60 до 250 нм) и
электронной плотности; в ряде случаев в саркоплазме кардиомиоцитов
обнаруживались лишь "тени" безмембранных гранул. Средние значения
диаметра безмембранных специфических гранул составили в предсердном миокарде
125±21 нм. Существование указанных разобщенных групп, содержащих мембранные и
безмембранные секреторные гранулы, позволяет сделать 2 важных заключения
относительно функционирования секреторного аппарата кардиомиоцитов: 1)
формирование гранул и их продвижение из внутренних клеточных участков в
субсарколеммальную зону осуществляется дискретно, определенными порциями (по
10-25 гранул) (рис. 80); 2) выделение содержимого секреторных гранул
(дегрануляция) происходит не только в зоне, прилежащей к клеточной мембране, но
и в глубоких участках саркоплазмы кардиомиоцитов.
Литература:
1. Фролов В.А.. Морфология митохондрий
кардиомиоцитов в норме и патологии / В.А. Фролов, В.П. Пухлянко – М. : Изд.
Универс. Дружбы Народов, 1989. – 142с.
2.
Твердохліб І. В. Значення і використання інтегральних параметрів для вирішення
питань експериментальної морфології / І. В. Твердохліб, І. С. Хріпков,
Л. А. Романенко [та ін.] // Матер. І Всеукраїнської наук. конф. „Карповські
читання". - Дніпропетровськ, 2004. - С. 50-55.
3. Di Maio A.
Ultrastructure of the sarcoplasmic reticulum in cardiac myocytes from Pacific
bluefin tuna / A. Di
Maio, B. A. Block // Cell
Tissue Res. – 2008. – Vol. 334, № 1. – P. 121-34.