Медицина/9. Гігієна і
епідеміологія.
К. біол. н., с. н. с.
Крушевський В. Д.
Український науково-дослідний інститут
промислової медицини,м. Кривий Ріг, Україна
Вплив підвищеного вмісту
водневих іонів в розчинах імунокоректорів та антиоксидантів на формування
імунних комплексів при експериментальному
токсико-пиловому бронхіті
Останніми роками наголошується збільшення хронічних неспецифічних
захворювань легенів і, в першу чергу, професійного хронічного бронхіту (ХБ). В
даний час це захворювання займає одне з перших місць в професійній патології
[1,2].
ХБ
супроводжується істотними змінами в імунному статусі. Тому при лікуванні ХБ в
клініці проводять корекцію цих порушень з використанням різних імунотропних
лікарських засобів, застосування яких стає в даний час стратегією, покликаною
служити підвищенню ефективності загальноприйнятого патогенетичного лікування
[3].
На думку
Л. А. Дуєвой для професійних легеневих захворювань найбільш інформативними
критеріями ефективності імунокорекції є зниження раніше підвищених рівнів
циркулюючих імунних комплексів (ЦІК) [4].
Відомо також, що важливою характеристикою ЦІК є їх розмір. Показано, що ЦІК, які утворювалися при надлишку антигену, мають невеликий розмір, не
активують комплемент і не викликають запальний процес. ЦІК, які утворилися при надлишку антитіл, хоча і
здатні активувати комплемент, але мають великий розмір, швидко фагоцитуються і
мають невелику патогенність. Найбільшим патогенним потенціалом володіють ЦІК середніх розмірів, які утворюються при
незначному надлишку антигену, здатні активувати комплемент, при цьому повільно елімінуються [5].
За даними клінічних і експериментальних досліджень з
фізико-хімічних властивостей ЦІК в сироватці крові, а, зокрема їх розмірів, при
ХБ професійній етіології наголошується посилене формування ЦІК середніх
розмірів, тобто найбільш патогенних [6,7,8].
Проте, відомості про взаємозв'язок змісту і розмірів ЦІК
в організмі при професійному ХБ, а також способах підвищення ефективності
іммунотропних засобів сьогодні вельми не численні [7,8,9,10].
Метою даної роботи є розробка найефективніших комплексів іммунотропних засобів по корекції формування ЦІК при експериментальному токсико-пиловому бронхіті.
Для реалізації поставленої мети був змодельований експериментальний
токсико-пиловий бронхіт з отриманням характерних морфологічних змін в
бронхо-легеневій системі [11].
Дослідження проводилися на 130 безпородних
білих щурах Всі піддослідні тварини піддавалися 3-х місячним сполученим
інгаляційним діям оксидів азоту і аморфного діоксиду кремнію в концентрації 5 ГДК
і 15-20 ГДК відповідно 5 разів на тиждень по 4 години.·
Оксиди азоту одержували в колбі Вюрца реакціями взаємодії
44,4% водного розчину Na2NO2 з 50% водним розчином
сірчаної кислоти, які подавалися в циліндрову камеру приманки місткістю 1м3 за
допомогою повітряної барботації. Контроль за концентрацією оксидів азоту в
камері здійснювався фотометрично через кожні 30 хвилин [12].
З
аерозолів був вибраний аморфний діоксид кремнію з розміром частинок менш, ніж 1 мкм
з питомою поверхнею 100 м2/г, критерієм для
вибору якого була концепція підвищеної швидкості кліренсу пилових частинок,
обумовлена їх гидрофобностью.
Для відробітку режимів
інгаляції використовувалися ежекційно-дискові пилоподавачі. Вимірювання концентрацій
пилу в камерах здійснювалися стандартним гравіметричним методом на фільтри АФА-ВП-20. Відбір проб пилу проводився впродовж всього терміну інгаляційних приманок дискретно з 1-2-х
хвилинними перервами на заміну фільтру.
Для імунокорекції використовувалися препарат вілочкової залози
тімоген і препарат селезінки - спленін.
Імунокоректори вводили внутрішньом’язово щодня впродовж останніх 2-х тижнів від початку досліду в дозах: тімоген - 1 мкг/100 г маси тіла тварин, спленін
- 0,29 мкл/100 г.
Враховуючи взаємозв'язок імунних і вільно-радикальних
процесів введення іммунотропних засобів здійснювали в поєднанні з
антиоксидантами прямої дії: аєвіт, аскорбінову і ліпоєву кислоту.
Антиоксиданти вводилися перорально щодня
протягом останніх двох місяців від початку інгаляційних дій бронхітогенних
агентів в дозах: аєвіт -
5 мг на 100 г маси тіла тварин, ліпоєва кислота – 0,14 мг на 100 г, аскорбінова
кислота - 0,6 мг/100 г.
Для зменшення погрішності доз антиоксидантів і
імунокоректорів, що вводилися піддослідним тваринам, використовувалися наступні
їх розведення в ізотонічному розчині хлориду натрію рН=7,3: аскорбінова кислота
- 0,24%, ліпоєва кислота – 0,24%, тімоген – 0,0004%, спленін - 0,12%. Аєвіт (у
соняшниковій олії) - 0,7% (1мл розчину містить 0,75 мг аєвіту).
Окрім цього для збільшення біологічної
активності водорозчинних антиоксидантів і імунокоректорів здійснювалося їх
розведення ізотонічному розчині хлориду натрію із вмістом водневих іонів
1,25•10–3 г-іон/л (рН=2,9). Це обумовлено механізмом інгібування вільно-радикального окиснення
(СРО) антиоксидантами прямої дії, тобто відновленням активних вільних радикалів
антиоксидантами в стабільну молекулярну форму, внаслідок чого відбувається окиснення
антиоксиданту в радикал: R•·+ InH → RH
+ In•. Ці антиоксидантні радикали як пасивні частинки не здатні
продовжити ланцюг аутоокиснення, але і не здібні до подальшого інгібування СРО.
Тому введення антиоксидантів в організм з надміром водневих іонів дозволяє
реактивувати їх інгібуючу здатність.
Дослідження
проводилися на 10 дослідних серіях тварин з різними комбінаціями сполученої дії
імунокоректорів і антиоксидантів:
1 серія: тімоген + аєвіт;
2 серія:
тімогенΘ + аєвіт (Θ
- активований розчин);
3 серія:
спленін + аєвіт;
4 серія:
спленінΘ + аєвіт;
5 серія:
тімоген + спленін + ліпоєва к-та;
6 серія:
тімоген + спленін + ліпоєва к-таΘ;
7 серія: тімоген + спленін + ліпоєва к-та + аскорбінова
к-та;
8 серія: тімогенΘ + спленінΘ
+ ліпоєва к-таΘ +
аскорбінова к-таΘ;
9 серія: тімоген + спленін + аскорбінова к-та;
10 серія: тімоген + спленін + аскорбінова
к-таΘ;
і на 2 контрольних серіях тварин:
11 серія: тварин піддавали бронхітогенним
інгаляціям без коректорів;
12 серія: інтактні тварини.
Після закінчення експерименту
тварин вмертвляли при легкій наркотизації декапітацією. Відпрепаровані легені
подрібнювали препаровальними ножицями, гомогенізували в ізотонічному розчині
хлориду натрію в співвідношенні 1:10 при температурі 0оС, визначали
вміст і розміри ЦІК в сироватці крові і у фільтраті гомогенату легень [13,14].
Аналіз
результатів дослідження за порівняльною оцінкою ефективності корекції вмісту і
розмірів ЦІК при дії різних комбінацій іммунокорректоров і антиоксидантів при
експериментальному токсико-пиловому бронхіті показав, що найбільшою біологічною
активністю володіє комплекс тімогена, спленіна, ліпоєвої і аскорбінової кислот
із вмістом водневих іонів 1,25•10–3 г-іон/л. В цьому випадку
показники вмісту ЦІК як в крові, так і в легенях піддослідних тварин не мають достовірних відмінностей від таких
інтактних тварин серії №12, але нижче майже в 2 рази, ніж в 11 контрольній
серії тварин (мал.). При цьому середній коефіцієнт, що визначає їх розміри,
значно виходить за межі найбільш патогенних ЦІК і відповідає в крові в 80%
випадків, а в легенях в 70% малим розмірам комплексів, які не активують
комплемент і не викликають запальний процес (табл.).
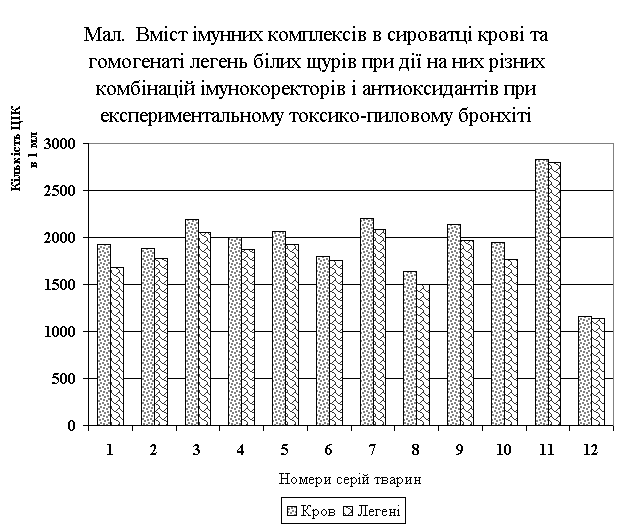
Подальший
розподіл зниження ефективності корекції вмісту ЦІК як у крові, так і в легенях
експериментальних тварин відбувається в наступній послідовності: серії № 6, 2,
1, 10, 4, 5, 8, 3, 9, 11.
При цьому необхідно відзначити, що залежно від збільшення вмісту ЦІК в цьому
розподілі наголошується збільшення формування комплексів середніх розмірів.
Так, у інтактних тварин в 70-80% випадків визначені ЦІК малих розмірів, у контрольних тварин 11
серії переважають середні комплекси (62,5-75%). У тварин 3, 5, 8 і 9 серій цей
показник близький до коефіцієнту, який відповідає середнім розмірам комплексів
і в крові і в легенях (табл.).
Не можна стверджувати, що результати
активації, тобто підвищення вмісту водневих іонів водорозчинних імунокоректорів
і антиоксидантів при різних досліджених комбінаціях їх дії на експериментальних
тварин в даному досліді носить лінійну залежність.
Таблиця
Розміри імунних комплексів в сироватці крові і гомогенатах легень білих щурів при дії на них
різних комбінацій імунокоректорів і антиоксидантів при експериментальному
токсико-пилового бронхіті
|
№ серії |
Розміри ЦІК, ум. од. |
Найменування коректорів |
|||
|
Кр (M±m) % |
|||||
|
Кров |
n |
Легені |
n |
||
|
1 |
2,09±0,18(*)(**) 88,9 |
9 |
2,04±0,26 77,8 |
9 |
Тімоген + аєвіт
|
|
2 |
2,29±0,28(*) 83,3 |
12 |
2,25±0,33 75,0 |
12 |
ТімогенΘ+ аєвіт |
|
3 |
1,68±0,14(**) 76,9 |
13 |
1,58±0,23(**) 69,2 |
13 |
Спленін + аєвіт |
|
4 |
1,91±0,17(*)(**) 80,0 |
10 |
1,85±0,21 70,0 |
10 |
СпленінΘ+ аєвіт |
|
5 |
1,72±0,11(**) 72,2 |
18 |
1,65±0,13(**) 66,7 |
18 |
Тімоген+спленін+ліпоєва к-та |
|
6 |
2,35±0,37(*) 71,4 |
7 |
2,32±0,43 57,1 |
7 |
Тімоген+спленін+ліпоєва к-таΘ |
|
7 |
2,48±0,33(*) 80,0 |
10 |
2,39±0,42 70,0 |
10 |
ТімогенΘ+спленінΘ+ліпоєва к-таΘ+аскорбінова к-таΘ |
|
8 |
1,61±0,17(**) 87,5 |
8 |
1,55±0,19(**) 75,0 |
8 |
Тімоген+спленін+ліпоєва к-та+аскорбінова к-та |
|
9 |
1,70±0,19(**) 77,8 |
9 |
1,60±0,20(**) 66,7 |
9 |
Тімоген+спленін+аскорбінова к-та |
|
10 |
2,01±0,19(*)(**) 88,9 |
9 |
1,87±0,20 66,7 |
9 |
Тімоген+спленін+аскорбінова к-таΘ |
|
11 |
1,32±0,19 75,0 |
8 |
1,46±0,20 62,5 |
8 |
Контроль без коректорів
|
|
12 |
2,67±0,11 80,0 |
10 |
2,65±0,38 70,0 |
10 |
Контроль інтактні
|
Примітки: (*)– відмінності
достовірні, Р<0,05 (щодо серії №11)
(**) –
відмінності достовірні, Р<0,05 (щодо серії №12)
Θ - активовані
імунокоректори і антиоксиданти;
n – кількість тварин.
Тобто, якщо перше місце по ефективності інгібування
накопичення ЦІК в крові і легенях тварин зайняла сьома серія, де всі розчини,
що вводяться, були активовані, то серія з аналогічною комбінацією, але без
активації знаходиться на 10 місці. А у разі поєднаної дії тімогену і аєвіту
активація збільшує ефективність лише на одну позицію (серії №1, 2).
Проте, у всіх досліджених комбінаціях
показана вища ефективність водорозчинних іммунокоректоров і антиоксидантів з
підвищеним вмістом водневих іонів (табл. 1,2).
Висновки
1.
Збільшення вмісту водневих іонів до 1,25•10–3
г-іон/л в розчинах імунокоректорів і антиоксидантів активує їх інгібуючу здібність
до накопичення ЦІК в крові і легенях, а також формуванню комплексів середніх
найбільш патогенних розмірів при експериментальному токсико-пиловому бронхіті
до контрольних параметрів.
2.
Найефективнішим іммунотропним засобом по
виведенню ЦІК і особливо найбільш патогенних в даних дослідженнях є поєднана
дія активованого комплексу тімогену, спленіну, ліпоєвої і аскорбінової кислот.
3.
Комбінування неактивованих і активованих
іммунокоректоров і антиоксидантів за рахунок збільшення вмісту водневих іонів
до 1,25•10–3 г-іон/л не може бути універсальним і потребує
відповідного коректування у кожному конкретному випадку.
4.
Співвідношення вмісту і розмірів ЦІК в крові
і легенях експериментальних тварин в залежності від досліджених комплексів імунотропних
засобів прямо пропорціонально їх ефективності, тобто зниженню концентрації загальних
ЦІК супроводить зменшення формування середніх найбільш патогенних комплексів.
Литература
1.
Кундиев
Ю. И. Медицина
труда на Украине на пороге XXI века //Медицина труда и промышленная
этиология.-1998.-№6.-С.9-13.
2.
Измеров
Н. Ф. Медицина труда в третьем тысячелетии //Медицина труда и промышленная
экология.-1998.-№6.-С.4-9.
3.
Дуева
Л. А. Значение иммунокорректоров в комплексной терапии профессиональных
заболеваний бронхолёгочной системы// Медицина труда и промышленная экология.
-2002. -№12. –С. 37-44.
4.
Чернушенко
Е. Ф. Иммунокорригирующая терапия// Журнал практичного
лікаря.-2001.-№1.-С. 24-27.
5.
Стручков
П. В., Константинова Н. А., Чучалин А. Г. и др. Изменения физико-химических
свойств при гемосорбции// Советская медицина.-1985.-№1.-С.35-39.
6.
Чернушенко
Е. Ф., Когосова Л. С., Гнатко Е. П. и др. Аутоиммунные процессы и их роль в
клинике внутренних болезней. - К.: Здоров’я –
1985.- 160 с.
7.
Карнаух М. Г., Крушевський В. Д. Розміри
циркулюючих імунних комплексів у білих щурів при хронічній інгаляційній дії
оксидів азоту, сірки та кремнію// Современные проблемы токсикологии.-2004.-№2.-С. 12-16.
8.
Крушевский В. Д., Гирин С. В., Рубцов Р. В., Бондарчук О.
М., Кривошей Л. А. Размеры циркулирующих иммунных комплексов у больных
хроническим бронхитом при использовании различных способов лечения// Український пуль монологічний журнал.-1997.-№1.-С. 33-35.
9.
Тонкопряд
І. В., Рубцов Р. В., Крушевський В. Д. Вплив методів
екстракорпоральної детоксикації на рівень та розміри циркулюючих імунних комплексів
у лікуванні тяжкої стадії професійно обумовленої хронічної обструктивної
хвороби легень// Медичні перспективи.-2005.-Том
Х.-№2.-С. 58-60.
10.
Крушевський
В. Д., Беднарик О. М., Луговський С. П., Ковальчук Т. А., Рубцов
Р. В., Гірін С.В., Бондарчук О. М. Спосіб імунокорекції активованим тимогеном//
Патент на винахід №29053 А, UA, А61В10/00, А61К35/55,16.10.2000. Бюл.№5-11.
11.
Карнаух М. Г., Крушевський В. Д., Луговський
С. П., Комаров М.А. Морфофункціональні зміни в легенях лабораторних тварин у
патогенезі експериментального хронічного бронхіту токсичної та пилової
етіології// Гігієна населених місць.-2003.-Вип. 41.-С.53-58.
12.
Методические
указания на фотометрическое определение двуокиси азота в воздухе/№1638-77
Утверждены МЗ СССР/18 апреля 1977г.
13.
Белокриницкий
Д. В. Методы клинической
иммунологии// Лабораторные методы исследования в клинике / Под ред. В. В. Меньшикова.- М.: Медицина, 1987.-С.292.
14.
Стручков
П. В.,
Константинова Н. А., Чучалин А. Г. и др. Изменения физико-химических свойств
иммунных комплексов при гемосорбции// Советская медицина.-1985.-№1.-С.35-39.