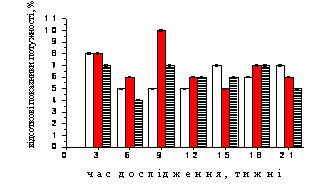Биологические науки/8.
Физиология человека и животных
К.б.н. Чаус
Т. Г., Коновалюк О. В.
Дніпропетровський
національний університет, Україна
Особливості формування електричної активності трофотропної зони
гіпоталамусу щурів за умов стресу та пригнічення синтезу нейромедіаторів
резерпіном
Вступ. Як відомо, гіпоталамус є
однією
із ключових ланок функціональної інтегративної системи, яка контролює емоційну
поведінку людини і тварин, запускає формування вегетативних компонентів
пристосувальних реакцій, забезпечує виживання особини та виду в цілому [1-3].
Ці важливі функції забезпечуються складними нейронними мережами різної
нейромедіаторної природи. Численними дослідженнями продемонстровано особливу
роль ерго- та трофотропної зон гіпоталамусу у пристосувальних реакціях
організму, зокрема за умов стресу [4-6]. При цьому стає очевидним, що відмінності
медіаторних систем у передньому (трофотропному) та задньому (ерготропному)
гіпоталамусі будуть призводити до різних механізмів їх модуляції, які за умов
розвитку стрес-реакції будуть працювати по різному [7-9]. В тому числі було
показано [10], що за умов дії емоційних стресорів спостерігається суттєво більш
позитивна кореляція між підвищенням рівня норадреналіну (НА) у
паравентрикулярному ядрі гіпоталамуса та опосередкованою НА активацією
гіпоталамо-гіпофізарно-адреналової вісі, ніж за умов фізичних стресорів. Важливим
є також дослідження механізмів регуляції гіпоталамусу на фоні розвитку довготривалого
стресу за рахунок модуляції синаптичної передачі резерпіном, оскільки механізми
його впливу на головний мозок в цілому та нейронні ланцюги гіпоталамусу зокрема
пов'язані перш за все з пресинаптичною блокадою адренергічних волокон та
зменшенням синтезу НА [11-12]. Все вищевикладене вказує на те, що дослідження електричної
активності (ЕА) гіпоталамусу за умов стресу і модулювання синаптичної передачі резерпіном
є цілком актуальним, що й лягло в основу даного дослідження.
Методика дослідження. Дослідження були
проведені на 89 нелінійних щурах-самцях, яких було поділено на групи наступним
чином. Тварини першої групи слугувала контролем (n=35). Друга (n=33) та тертя (n=21) групи були представлені щурами, яким створювали
стресову зооконфліктну ситуацію шляхом обмеження життєвого простору до 8,0-10,0
см2 на одну тварину. Це досягалося тим, що в стандартну клітину
розміром 0,3х0,5 м [13], де повинно утримуватись 2-3 тварини, розміщували 20-22
щура. Для тварин цього виду така ситуація служить сильним стресовим фактором
[14-15]. Паралельно з цим до тварин третьої групи застосовували 3,4,5-триметоксі-бензоат метилрезерпат. Фармакологічна назва
– резерпін, добова потреба якого становила 5 мг/кг/доба [16-17].
У нашій
роботі при гострому експерименту ми проводили реєстрацію електричної активності
трофотропної зони гіпоталамусу за допомогою стереотаксичного методу відведення
біопотенціалів [18] кожні 3 тижні, тобто через 3, 6, 9, 12, 15, 18, 21 тиждень
паралельно у тварин всіх досліджуваних груп. Хірургічна процедура підготовки до
експерименту виконувалась під дією наркозу: кетаміну гідрохлорид (20 мг/кг) та
тіопенталу натрію (50 мг/кг). Розчин наркозу вводили інсуліновими шприцами у
черевну порожнину щура в районі задніх кінцівок. Наркотизовану тварину
закріплювали в стереотаксичному приладі СЕЖ-2 (за конструкцією Ю. М. Беленьова)
і проводили трепанацію черепа з подальшим вживленням ніхромового електроду
товщиною 100 мкм у відповідну зону гіпоталамусу. Координати трофотропної зони
гіпоталамусу визначали за стереотаксичним атласом [19]. Реєстрацію
біопотенціалів гіпоталамограми проводили за допомогою відповідної апаратури:
поліграфу П6Ч-01 (Україна) та стандартного електрофізіологічного
устаткування з 16-розрядним АЦП з частотою вибірки – 512 Гц (Інститут
фізіології ім. О. О. Богомольця, м. Київ). Аналіз записаних кривих проводили за допомогою
комп’ютерної програми “Eksperiment” (Інститут фізіології ім. О. О. Богомольця,
м. Київ) та “Mathcad
Результати та їх обговорення. Як зазначалося, в основі
адаптації організму до основних факторів середовища лежить формування
розгалуженого структурного сліду адаптацій, який охоплює численні органи і
системи, та адаптивне збільшення потужності центральних та периферичних
стрес-лімітуючи систем. Також слід згадати положення, яке сформулював у 1984 р.
П. В. Симонов, про те, що емоційний стрес як цілісний стан організму має
центральне походження і першочергово формується у гіпоталамусі. Резерпін у
людини і тварин викликає своєрідний седативний ефект, який проявляється
зменшенням нервової перенапруги та рухової збудливості, стимулює перистальтику
шлунково-кишкового тракту, понижує артеріальний тиск та ін. Механізм адаптивної
і гіпотензивної дії резерпіну пов’язують з метаболізмом моноамінергічних
медіаторів, у першу чергу катехоламінів та серотоніну. Окрім того, він перешкоджає
депонуванню моноамінів у тканинах. У результаті їх вміст у головному мозку,
серці та кровоносних судинах понижується. Виходячи з цього можна припустити, що
резерпін так чи інакше буде впливати і на біоелектричну активність гіпоталамусу
за умов розвитку стрес-реакції, про що свідчать
отримання нами результати.
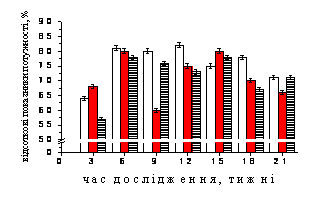
Дослідження динаміки відсоткових
значень потужності у дельта-діапазоні (рис. 1, А) тварин, до яких на фоні
стресу застосовували резерпін, показало, що майже завжди відсоток ритму у щурів
цієї групи був достовірно (Р<0,05) меншим за показники контролю. І
лише через 21 тиждень від початку досліду ці значення відновлювались до
результатів, отриманих за фізіологічних умов. На початку експерименту відсоток
дельта-подібної активності у тварин 3 групи був мінімальним і становив 57,22±0,58
%, але вже через 6 тижнів дослідження відмічалось його істотне збільшення до
78,03±0,77 %, що було максимальним для тварин цієї групи. Надалі відмічалась
певна нестабільність у динаміці відсоткових значень у дельта-діапазоні, які
наприкінці експерименту відновлювались до значень контролю.
|
А |
Б
|
|
В
|
Г
|
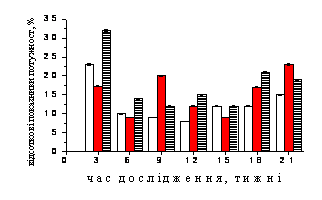
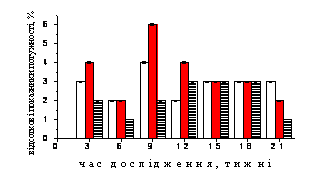
Рис. 1. Динаміка нормованих спектральних
потужностей (%) частотних компонентів електрогіпоталамограми, відведеної від трофотропної
зони гіпоталамусу щурів контрольної (1), стресової (2) груп та тварин, до яких на фоні стресу застосовували резерпін
(3).
А-Г – динаміка відсоткових показників потужності коливань дельта-, тета-,
альфа- та бета-діапазонів відповідно. По осі абсцис – термін спостереження,
тижні; по осі ординат – відсоткові значення потужності, %.
У динаміці відсоткових значень
потужності дельта-діапазону тварин, до яких на фоні стресу застосовували
резерпін, нами були відмічені певні кореляційні зв’язки лише з відповідними
показниками щурів контрольної групи, де коефіцієнт кореляції становив r=0,75
(P>0,05).
Відсоток тета-подібної активності вже
через 3 тижні дослідження був
максимальним і дорівнював
32,48±0,39 % (рис.1, Б). До
того ж
цей результат був більшим за
аналогічні показники тварин 1 та 2 груп. Через 6-9 тижнів експерименту
спостерігалось поступове зменшення відсотку тета-подібної активності до
12,89±0,15 %, що для тварин даної групи було мінімальним. На 18 тижні
дослідження відмічалось зростання відсотку ритму до 21,36±0,27 % і хоча через
21 тиждень його значення дещо зменшувались на фоні стресу, але вони були
більшими за показники тварин контрольної групи. Проведення аналізу динаміки
відсоткових значень потужності у тета-діапазоні було відмічено досить високе
значення коефіцієнту кореляції лише у тварин 1 та 3 груп між даними показниками
(r=0,90), що скасовувало нульову гіпотезу на високому рівні достовірності
(P<0,01).
Зміни відсоткових значень у діапазоні 8-13 Гц тварин, до
який застосовували резерпін, майже завжди були меншими за відповідні показники
щурів контрольної та стресової груп (рис. 1, В). На перших тижнях дослідження
(через 3-6 тижнів) спостерігалось зменшення відсотку даного виду електричної
активності з 7,45±0,07 % до 4,36±0,04 %, які вже через 9 тижнів експерименту
відновлювались до початкових значень і майже до кінця досліду залишались в
межах 6-7 %. Проте, кореляційний аналіз між
змінами відсоткових значень потужності у діапазоні 8-13 Гц тварин досліджуваних
груп дозволив виявити деякі відмінності. Так, між відповідними показниками
тварин 1 та 3 груп протягом всього часу дослідження майже не відмічалось ніяких
лінійних кореляційних зв’язків. Проте, цей коефіцієнт дещо зростав
між показниками щурів 2 та 3 груп, досягаючи r=0,60 (P>0,05).
Зміни
відсоткових значень потужності у діапазоні 14-30 Гц тварин 3 групи мали більш стабільний характер на відміну
від динаміки його потужності (рис.
Аналізуючи отримані результати слід
зазначити, що через 9 тижнів експерименту у тварин за умов стресу спостерігався
потужний десинхронізуючий ефект у
трофотропній зоні гіпоталамусу (виснаження нейропередачі та модуляція
збуджуючих амінокислот, або зміна характеру квантування). Резерпін в цей час за
умов синаптичної блокади у задньому гіпоталамусі стимулює холінергічну
нейропередачу та відміняє цей ефект по відношенню до контролю. Ефекти
синхронізації та десинхронізації у гіпоталамусі щурів, до яких на фоні стресу
застосовували резерпін, мають протилежний характер, що може свідчити про
потужні енергосублімуючі зв’язки поміж них. Можливо, резерпін посилює цю
протифазність за рахунок симпатоблокуючої дії. Резерпін покращує також утворення
адаптаційно-пристосувальних реакцій мозку, що через 15 та 21 тиждень
дослідження проявилось у підвищенні потужності дельта-ритму у трофотропній зоні
гіпоталамусу.
Висновки.
1. Резерпін,
який блокує катехоламінову нейропередачу у задньому гіпоталамусі, тимчасово
відміняє його первинну реакцію на тривалий зооконфліктний стрес у виді
підвищення потужності дельта-ритму, активуючи ефекти десинхронізації.
2. Відміна
симпатомімітичної блокади резерпіну у гіпоталамусі тимчасова і відбувається на
9 тижні розвитку стрес-реакції, що може бути обумовлено конкуруючою активацією
медіатор синтезуючих систем та модулюючим впливом збуджуючих амінокислот (ЗАК)
на постсинаптичні мембрани.
3. Вивчення
впливу резерпіну на електрофізіологічні властивості гіпоталамусу дає зробити
висновок, що пониження синтезу нейротрансміттеру і, відповідно, його
концентрації у синаптичній щілині, супроводжуються достовірною десинхронізацією
гіпоталамограми.
Література:
1.
Агаджанян Н. А. Адаптация и резервы организма. – М.:
Физкультура и спорт, 1983. – 176 с.
2.
Корнева Е. А., Шекоян В. А. Регуляция защитных функций
организма. – М.: Наука, 1982. – С. 32-54
3.
Баклаваджян О. Г. Вегетативные механизмы гипоталамуса /
Физиология вегетативной нервной системы. – Л., 1981. – С. 389-474
4.
Пшенникова М. Г. Феномен стресса // Пат. Физиология и
экспериментальная терапия. – 2000. – № 2. – С. 24-31
5.
Латаш Л. П. Гапоталамус. Приспособительная активность.
Электроэнцефалограмма. – М.: Наука, 1968. – 295 с.
6.
Вейн А. М. Вегетативные расстройства. – М.: МИА, 2003.
– С. 500-514
7.
Fridman E. M., Irvin M. R. A role for CRH and the
sympathetic nervous system in stress-induced immunosuppression // Ann. N. Y.
Acad. Sci. – 1995. – Vol. 771. – P. 396 – 418.
8.
Whitnall M. H. Regulation of the hypothalamic
corticotrophin-releasing hormone neurosecretory system // Progr. Neurobid. –
1993. – Vol. 40. – P. 573 – 629.
9.
Jezova D., Skultetyova I., Tokarev D. I et al.
Vasopressin and oxytocin in stress // Ann. N. Y. Acad. Sci. – 1995. – Vol. 771.
– P. 192 – 203.
10. Pacak
K., Palkovits M., Kvetnasky R. et al. Effects of various stressors on in vivo notepinephrine release in the
hypothalamic paraventricular nucleus and on the pituitary-adrenocortical axis
// Ann. N. Y. Acad. Sci. – 1995. – Vol. 771. – P. 115 – 130.
11. Зацепилова Т. А. Симпатолитики // Московские аптеки. – 2005. -
№ 10. – С. 143.
12. Преображенский Д. В., Маренич А. В.,
Пересыпко М. К. Место резерпина в современной терапии артериальной гипертензии:
выдержал ли он испытание временем? // Справочник поликлинического врача.
Кардиология. – 2005. – Т. 3, № 5. – С. 12-25.
13. Ляшенко В. П., Лукашов С. М., Зорова
Ж. В., Політаєва В. І. Спосіб моделювання атеросклерозу. Деклараційний патент
на винахід 7G09B23/28. – 2002.
14. Резніков О. Г., Сініцин П. В.,
Тарасенко Л. В. Реакція гіпоталамо-гіпофізарно-адренокортикальної системи на
норадренергічну та гормональну стимуляцію у пренатально стресованих щурів
//Нейрофізіологія. – 1999. – Т. 31, № 2. – С.134-137.
15. Данилов Г. Е., Брындина И. Г.,
Исакова Л. С. и др. Стабильные гомеостатические константы и эндокринный статус
при хроническом нейрогенном стрессе и стресс-протекторных воздействиях //Арх.
клиническ. экспер. медицины. – 2000. – Т.9, №1. – С.71-74.
16. Neznamov G. G.,
17. Kalinina T. S., Garibova T. L.,
Voronina T. A. Discriminative effects of phenazepam and gidazepam in rats:
comparison with other GABA-related drugs // Pharmacoil. Biochem. Behave. –
1999. – Vol. 64, № 2. – P. 397-401.
18. Буреш Я., Петрань М., Захар И.
Электрофизиологические методы исследования. – М.: Из-во иностранной литературы,
1962. – 451 с.
19. Zilles K. The Cortex of the Rat. A Stereotaxic Atlas. –
20. Лакин Г.В. Биометрия. – М.: Высшая
школа, 1990. –352 с.