Химия и
химические технологии
2.
Теоретическая химия
Оковитый С.И., Дрюк В.Г.
Днепропетровский национальный университет;
Южный филиал «Крымский агротехнологический университет»
национального аграрного университета
ЭПОКСИДИРОВАНИЕ
ЭТИЛЕНА ПЕРФТОРИРОВАННЫМ
АЛКИЛГИДРОПЕРОКСИДОМ –
КВАНТОВО-ХИМИЧЕСКОЕ РАССМОТРЕНИЕ
Гидропероксид водорода как окислитель недостаточно активен, чтобы эпоксидировать алкены. Однако в присутствии ряда добавок пероксид водорода может трансформироваться в гидропероксиды, превосходящие его по окислительной способности и способные эпоксидировать алкены [1,2]. Кроме классической реакции ацилирования Н2О2 карбоновыми кислотами и ангидридами кислот, ведущей к образованию пероксикислот, следует отметить следующие реакции:
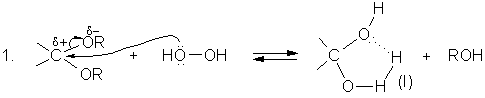
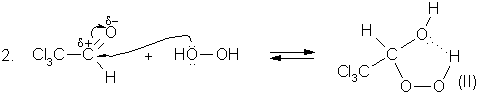
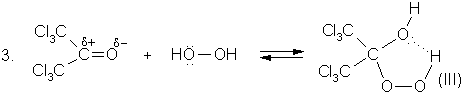
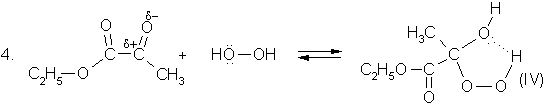
Наличие электроакцепторных заместителей (![]() ) в гидропероксидах (I-IV)
понижает энергию разрыва пероксидной связи и, естественно, повышает их
окислительную способность, делая возможным эпоксидирование алкенов.
) в гидропероксидах (I-IV)
понижает энергию разрыва пероксидной связи и, естественно, повышает их
окислительную способность, делая возможным эпоксидирование алкенов.
Установлено, что электрофильная активация пероксида водорода, достаточная для эпоксидирования активных олефинов, осуществляется в среде перфторированных спиртов: гексафторпропанола, 2,2,2-трифторэтанола и перфторбутанола [3, 4].
Высказано предположение, что каталитическое действие перфторированных спиртов на эпоксидирование алкенов обусловлено образование ими водородных связей с пероксидом водорода. Однако по мнению авторов [5] столь слабые межмолекулярные взаимодействия как водородные связи, энергия которых варьируется в очень узком интервале, не могут существенно внять на энергию пероксидной связи в молекуле Н2О2 и, в конечном итоге, на ее окислительную способность.
В качестве рабочей гипотезы высказано предположение об образовании в исследуемой системе «Н2О2 – перфторированный спирт (RF – OH)» соответствующего перфторированного алкилгидропероксида (RF – ОOH), в котором пероксидная связь существенно активируется электроноакцепторным воздействием фторсодержащего алкильного фрагмента.
Образование гидропероксида RF – ОOH является результатом окисления фторированного спирта пероксидом водорода, суть которого заключается в переносе гидроксильной группы молекулы Н2О2 на нуклеофильную спиртовую группу
![]()
Аналогичное окисления реализуется в случае перокислот [1, c.68; 2, с.16], что доказано с помощью меченных атомов:
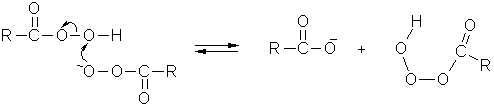
Такого типа механизм послужил основой для объяснения целого
ряда родственных реакций разложения соединений с активным кислородом, ведущих к
образованию синглетного кислорода (![]() ) [1, c.17-18; 2, с. 17-18].
) [1, c.17-18; 2, с. 17-18].
В настоящей работе проведено квантово-химической исследование поверхности потенциальной энергии (ППЭ) реакций:
- образования перфторированного гидропероксида – 1,1,1,3,3,3-гексафторпропангидропероксида в системе «(CF3)2CH–OH – H2O2» согласно схемы (1);
- эпоксидирования этилена пероксидом водорода и перфторированным пероксидным интермедиатом (СF3)2CH–OOH.
Для квантово-химических расчетов использовалась программа Gaussian03W
[6] в приближении UB HandHLYP/6-31G(d) [7]. Данный
метод ранее хорошо зарекомендовал себя при изучении механизма эпоксидирования
алкенов органическими пероксикислотами [8].
Проведено моделирование
реакции образования гидропероксида из 1,1,1,3,3,3-гексафтор-2-пропанола и
пероксида водорода. При этом учитывалась специфическая сольватация молекул
реагентов, обусловленная добавками воды. Молекула воды может включаться в
локализованное переходное состояние (ПС1) хелатного типа, обеспечивая
синхронный перенос электронной плотности:

В соответствии со структурой (ПС1) в ходе реакции осуществляется перенос гидроксильной группы пероксида водорода на молекулу спирта, а также перенос двух протонов: с молекулы воды на пероксид водорода и с молекулы спирта на молекулу воды. Описанная реакция может быть представлена следующей схемой:
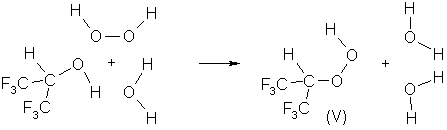
Рассчитанный барьер активации реакции, протекающей через (ПС1) составляет 28.00 ккал/моль.
При анализе ППЭ реакций эпоксидирования этилена пероксидом
водорода и фторированным гидропероксидом (V) локализованы соответствующие переходные состояния – ПС2 и ПС3.
Активационные барьеры реакций, а также некоторые геометрические параметры этих
переходных состояний приведены на рис. 1.

Еакт.
= 31,20 ккал/моль Еакт.
= 27,20 ккал/моль
Рис. 1. Структура переходных состояний и барьеры
активации реакций эпоксидирования этилена пероксидом водорода и
1,1,1,3,3,3-гексафторпропангидропероксидом, рассчитанные в приближении UBHandHLYP/6-31G(d).
Структуры, соответствующие переходным состояниям ПС2 и ПС3, имеют несимметричное строение, что согласуется с результатами расчета для эпоксидирования олефинов органическими пероксикислотами, описанными в [8, 9]. Так, длины образующихся связей С–О отличаются на 0,652 Å для системы "пероксид водорода – этилен", и на 0,582 Å для системы "гексафторпропангидропероксид – этилен".
Интересно отметить, что в случае пероксикислот переход от пероксиуксусной кислоты к более сильному окислителю – пероксималеиновой кислоте симметричность переходного состояния возрастает [1, c.126]. При сравнении эпоксидирующей способности Н2О2 и перфторированного алкилгидропероксида наблюдается такая же закономерность.
Сравнивая барьеры активации для обеих реакций, следует
отметить, что данная величина в случае эпоксидирования пероксидом водорода на
3,2 ккал/моль выше по сравнению с реакцией образования
1,1,1,3,3,3-гексафторпропангидропероксида и на 4,0 ккал/моль выше, чем барьер
активации реакции эпоксидирования этилена образовавшимся фторированным
алкилгидропероксидом. Такое понижение энергии активации обусловливает
увеличение скорости реакции эпоксидирования в присутствии фторированных
спиртов.
Суммируя вышеизложенные расчетные данные, можно сделать вывод о том, что наиболее вероятным эпоксидирующим агентом в исследуемой системе «(CF3)2CH–OH – H2O2» является 1,1,1,3,3,3-гексафторпропангидропероксид.
Библиографические ссылки
1. Дрюк В.Г., Карцев В.Г., Войцеховская М.А. Оксираны – синтез и биологическая активность. Механизм, ассоциативные и стерические эффекты пероксидного эпоксидирования. – М., 1999. – 527 с.
2. Dryuk V.G.,
Kartsev V.G., Dryuk M.A. Peroxide epoxidation of the alkenes: mechanism,
associative and stereochemical peculiarities. – Simferopol, 2001. – 249 p.
3.
Neimann
K., Neumann R. Electrophilic activation
of hydrogen peroxide: selective oxidation reactions in perfluorinated alcohol
solvents // Org. Lett. – 2000 – Vol. 2, N18. – P.2861-2863.
4.
Van
Viet M.C.A., Arends I.W.C.E., Sheldon R.A. Effective Solvents for Uncatalysed Epoxidation
with aqueous hydrogen peroxide // Synlett. – 2001. – P.248-250.
5. Оковитый С.И., Холод Я.А., Дрюк В.Г. // Вісник Дніпропетр. ун-ту. – №10. – 2004. – С. 12-17.
6.
Frisch
M., J. Trucks G. W., Schlegel H. B., et al / Gaussian 03, Revision A.I. –
Gaussian, Inc., Pittsburgh PA – 2003.
7.
Becke
A.D. Density-functional thermochemistry. III. The role of exact exchange // J.
Chem. Phys. – 1993 – Vol. 98, N7. – P. 5648-5654.
8.
Okovytyy
S, Gorb L., Leszczynski J. Is 2-oxabicyclobutane formed during the reaction of
peroxyacids with cyclopropene? A high-level ab initio study // Tetrahedron –
2002 – Vol. 58, N43, P. 8751-8758.
9.
Okovytyy
S, Gorb L., Leszczynski J. A reinvestigation of the mechanism of epoxidation of
alkenes by peroxyacids. A CASSCF and UQCISD study // Tetrahedron Letters – 2002
– Vol. 43, N23, P. 84215-4219.
Сведения об авторах статьи Оковитый С.И., Дрюк В.Г. "Эпоксидирование
этилена перфторированным алкилгидропероксидом – квантово-химическое рассмотрение".
Оковитый
Сергей Иванович – зав. кафедрой органической химии Днепропетровского национального
университета, доктор хим. наук.
Дрюк Валерий Григорьевич – профессор кафедры общей и агрономической химии Южного филиала "Крымский агротехнологический университет" национального аграрного университета (г. Симферополь, пос. Аграрное, ул. Парковая, 6, кв. 414 – 92495; дом. тел. – 8(0652) 26-35-10, моб. тел. – 8(095)857-49-53).