Медеубаева Б.З.1, к.т.н. Серба Н.Г.1,
д.т.н. Абжаппаров А.А.2, Клейус
Я.В.1
1
Восточно-Казахстанский государственный университет им. С.Аманжолова,
г. Усть-Каменогорск, Казахстан
2
Актауский государственный университет им. Ш.Есенова, г.Актау, Казахстан
ИССЛЕДОВАНИЕ ПРОЦЕССА КОМПЛЕКСООБРАЗОВАНИЯ
В СИСТЕМЕ Cu (II) - ИНУЛИН
Инулин является
полисахаридом, построенным из остатков D-фруктофуранозы, связанных 2,1-бета
связями.
Инулин
оказывает благотворное влияние в течение всего времени нахождения, в организме
человека начиная от попадания в желудок и заканчивая выделением. Инулин,
попадая в желудочно-кишечный тракт, расщепляется соляной кислотой и ферментами
на отдельные молекулы фруктозы и короткие фруктозные цепочки, которые проникают
в кровеносное русло. Оставшаяся нерасщепленная часть инулина быстро выводится,
связав собой большое количество ненужных организму веществ, таких как тяжелые
металлы, радионуклиды, кристаллы холестерина, жирные кислоты, различные
токсические химические соединения, попавшие в организм с пищей [1,2].
Практика
казахстанских и российских ученых подтвердила эффективность использования
инулина при многих заболеваниях, однако литературные данные по изучению
взаимодействия инулина с различными металлами крайне ограничены. Сведения о
составе и строении комплексов различных металлов с инулином в литературе не
обнаружены.
Целью
проводимого исследования является: рассмотреть возможность связывания тяжелых
металлов в комплексные соединения, таким природным соединением, как инулин.
С целью
изучения комплексообразующих свойств инулина с различными металлами было
проведено исследование комплекообразования ионов меди с инулином
спектрофотометрическим методом при t 25˚С и рН=2. Оптическую плотность растворов измеряли на
спектрофотометре СФ-46 в УФ области спектра (l = 10 мм) в диапазоне длин волн от 200
до 340 нм. рН
устанавливали на иономере универсальном И-130 со стеклянным и хлорсеребряным
электродами.
По полученным данным строился график зависимости А – f (л), где А –
оптическая плотности, л – длина волны. Для исследования были выбраны метод молярных отношений и
метод Жоба [3,4].
Для изучения кривых
светопоглощения комплексов Cu (II) с инулином необходимо иметь данные о спектрах поглощения
компонентов, вступающих в реакцию. На рисунке 1 представлены индивидуальные
спектры поглощения растворов инулина и нитрата меди.
Инулин в УФ области
спектра поглощает незначительно, раствор Cu (II) имеет полосу светопоглощения с
максимумом при лмах= 240 нм. В спектрах поглощения водных растворов
комплексов наблюдается смещение полос свелопоглощения с одновременным
изменением оптической плотности, что свидетельствует о происходящем в системе
комплексообразовании.
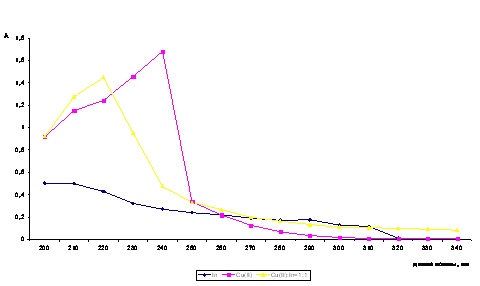

Рисунок 1 Зависимость
оптической плотности (А) от длины волны (l) для системы Cu2+ - инулин (рН = 2)
Для исследования состава
комплекса меди с инулином применяют метод непрерывных изменений (метод Жоба).
На рисунке 2 показаны спектры поглощения растворов Сu2+-инулин изомолярные серии при общей
(суммарной) концентрации компонентов 2 · 10-4 моль/л.
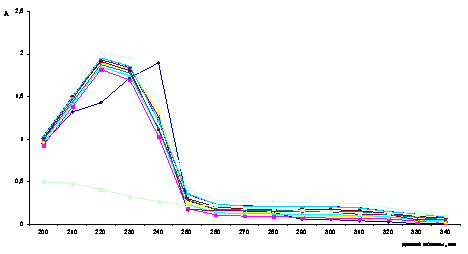
Рисунок 2 Спектры поглощения растворов Cu2+ - инулин изомолярной серии: С (Cu) + С (In) = 2×10-4 моль/л при рН = 2
Для определения состава
образующегося комплекса построили графическую зависимость между отклонения
оптической плотности от аддитивности и составом изомолярной смеси (∆А=f[CIn/(CCu+CIn)]).
![]()
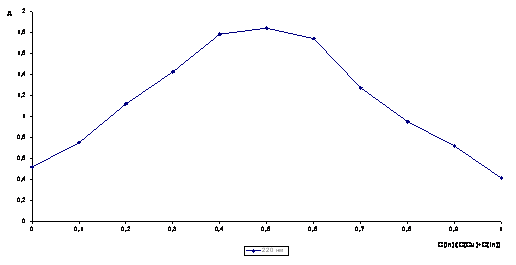

Рисунок 3 Зависимость
отклонения оптической плотности (А) от
состава изомолярного раствора для системы Cu2+ - инулин (рН = 2, С (Cu) + С (In) = 2×10-4 моль/л) при l= 220 нм
При отношении
концентрации CIn/CCu ≈ 0,5 наблюдается максимум светопоглощения на
изомолярной диаграмме, построенной при л = 220 нм. Из этих данных, что ионы
меди реагируют с инулином в соотношении 1:1.
В дальнейшем для полного
определения состава комплекса медь-инулин, проведено исследование спектров
поглощения методом молярных отношений, позволяющий получить представление о
формах образующихся комплексных соединений. Как видно из рисунков 4 и 5 в
системе медь-инулин происходит процесс комплексообразования.
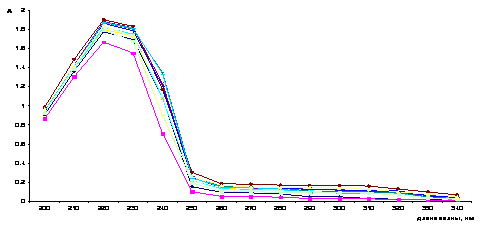

Рисунок 4 Кривая спектров
поглощения ионов меди (II) (СCu =1×10-4 моль/л )
при переменной концентрации инулина (рН = 2)
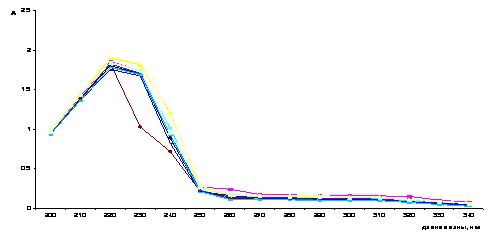
Рисунок 5 Кривая спектров
поглощения инулина (СIn =1×10-4 моль/л) при переменной
концентрации ионов меди (рН = 2)
По данным рисункам 4 и 5
были построены «кривые насыщения» (рисунки 6 и 7) По двум сериям растворов
соответственно.
![]()
![]()
![]()
![]()
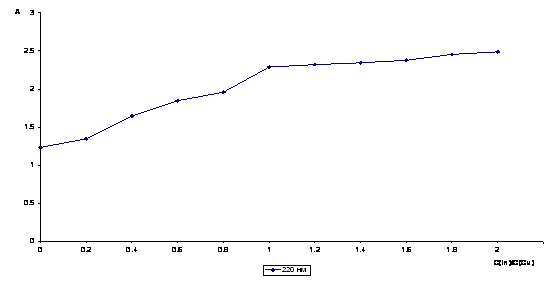
Рисунок 6 Кривая
насыщения DА = f(C(In) / C(Cu)), l = 220 нм, рН = 2
![]()
![]()
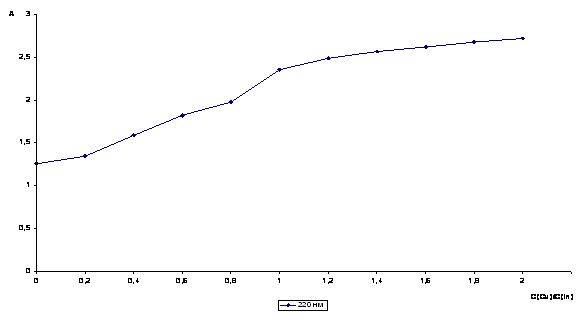

Рисунок 7 Кривая
насыщения DА = f(C(Cu) / C(In)), l = 220 нм, рН = 2
Анализ «кривых насыщения»
позволил определить стехиометрические отношения между компонентами реакции Cu (II)
к инулину как 0,98:1 или, проводя соответствующие преобразования,
получаем отношения 1:1.
По методу Клотца были
рассчитаны молярный коэффициент светопоглощения (eК = 4827) и константа устойчивости
образующегося комплекса (lgK = 4,27±0,032) [5].
ЛИТЕРАТУРА
1. Голубев В.Н. Топинамбур: состав,
свойства, способы переработки и области применения /В.Н.Голубев, И.В.Волкова,
Х.М.Кумаланов. – М., 1995.
2. Кохана Б.М. Биохимия топинамбура. -
Кишинев, 1974.
3. Полуэктов Н.С. Спектрофотометрические
методы определения индивидуальных РЗЭ – Н.С.Полуэктов, Л.И.Кононенко. - Киев:
Наукова Думка, 1968.
4. Бек М. Химия равновесий реакций
комплексообразования. - М.: Мир, 1973.
5. Яцимирский К.Б. Константы нестойкости
комплексных соединений / К.Б.Яцимирский, В.П.Васильев. – М.: Издательство АН
СССР, 1959.