Литвин В. А., Шишкина С. Н., Федоренко К. В.,
Галаган Р. Л.
Черкасский
национальный университет имени Б. Хмельницкого, Украина
Синтетические
фульваты как восстановитель в реакции образования нанокластеров серебра
Бактерицидные и иммуномодулирующие свойства наночастиц серебра хорошо
известны [1,2]. Однако, как было показано авторами [3], свойства серебряных
наночастиц приблизительно одинакового размера сильно зависят от природы внешней
стабилизирующей оболочки. В роли восстановителей Ag+-ионов в синтезе
таких систем используются разнообразные органические и неорганические вещества.
Известны, в частности, попытки использовать в роли восстановителя естественные
гуминовые вещества [4], поскольку им также присуще бактерицидное и
бактериостатическое действие и у комбинированного продукта можно ожидать
синергетического усиления этих свойств. Однако использование веществ
естественного гуминового комплекса наталкивается на проблему стандартизации их
свойств в соответствии с требованиями конкретных технологических процессов. В
данном исследовании мы поставили задачу замены в синтезе наночастиц серебра
естественных фульвокислот их синтетическими аналогами. Одним из давно известных
путей получения синтетических ФК является окислительная конденсация хинонов или
фенолов. Автором [5] синтезировано и охарактеризовано большое количество таких
продуктов, предшественниками которых были фенольные соединения
разнообразнейшего строения. Была исследована их физио-логическая активность и
показано, что большинству из них, как и естественным фульвокислотам, присуще
четко выраженное бактериоста-тическое действие и способность стимулировать
регенеративные процессы в тканях высших организмов.
Нанодисперсное серебро
сегодня вводится в состав многих полимер-ных и других материалов, применяющихся
для изготовления большого ко-личества изделий бытового и технического
назначения (корпуса мобиль-ных телефонов, моющие средства, специальные ткани,
БАД-ы и т.п.).
В
синтезе аналогов фульвокислот нами был использован естественный краситель гематоксилин
(7,11b-дигидро-цис-(+)-бенз(b)индено[1,2-b]пиран-3,4,6а,9,10(6Н)-пентол).
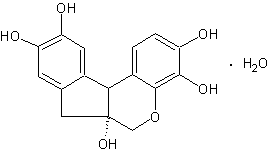
Применялась методика
синтеза, ранее описаная нами в [6].
Синтез
серебряного гидрозоля. Синтез и изучение кинетики про-цесса образования серебряного
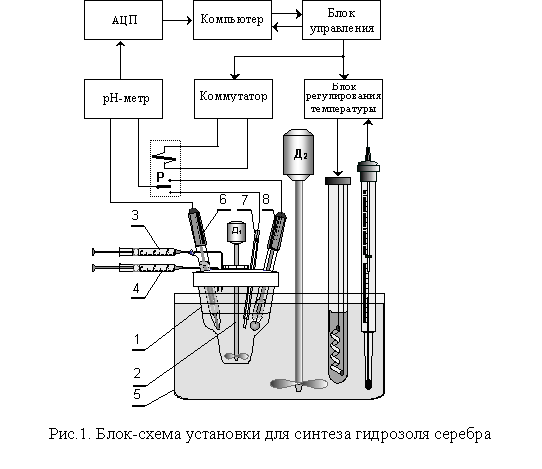
гидрозоля проводились в установке, принци-пиальная
схема которой приведенная на рис. 1.
В реакционный сосуд (1), оснащенный мешалкой (2) вносили
24 мл дистиллированной воды, аликвоту раствора синтетических фульвокислот с
содержанием сухого вещества 0.1 г, и помещали в водяной термостат (5). На
протяжении всего синтеза температура поддерживалась постоянной с точностью ± 0.5 ºС. После включения системы компьютерной регистрации
значений рН и окислительно-восстановительного потенциала серебряного индикаторного
электрода (7), в реакционную смесь с помощью дозаторов (3, 4) вводили
15 мл 0.2 М раствора AgNO3 и рассчитанный объем 1 М
раствора NaOH. Электродом сравнения (8) как при измерении рН с помощью
стеклянного электрода (6), так и активности Ag+-ионов служил
аргентум-оксидний полуэлемент с внутренним раствором состава – 0,01 М NaOH на фоне 0,5 М раствора KNO3.
Данные потенциометрических измерений в ходе синтеза автоматически записывались
компьютером в текстовый файл. По полученным данным строились кинетические
кривые.
Часть введенной в
реакцию щелочи немедленно расходуется на образование аргентум (І) оксида,
который в присутствии фульвокислот не выпадает в осадок, а образует коллоидную
микрофазу, ещё некоторое количество щелочи идет на нейтрализацию синтетических
фульвокислот с образованием фульват-анионов. Избыток щелочи необходим, как
нсточник нуклеофильных частиц ОН–, в процессе гидроксидирования
ароматических ядер фульвокислот по типу
реакции Элбса.
Реакционную смесь перемешивали на протяжении двух часов,
после чего проводили осаждение дисперсной фазы по одному из двух вариантов:
взаимодействие с ионами Сu2+, или другими многозарядными
металл-ионами; осаждение путем замены дисперсионной среды (вода ® ацетон).
Кинетические
кривые синтеза серебряного гидрозоля приведены на рис.2. Возрастание потенциала
электрода на участке ab отвечает увеличению равновесной концентрации Ag+-иона
вследствие смещения равновесия диссоциации аргентум (І) оксида из-за
снижения концентрации ОН–-ионов в системе. Они расходуются в реакции
окисления фенольных
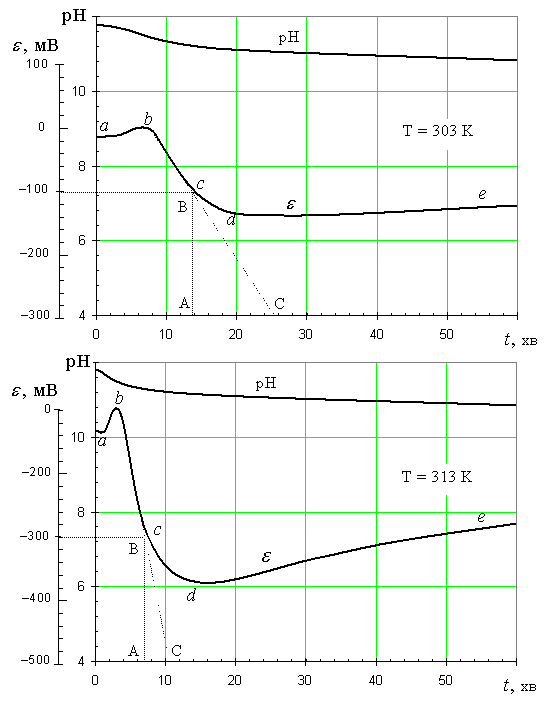
ядер ионами Ag+, протекающей по
типу реакции Элбса. Это ведет к постепенному
растворению микрофазы Ag2О. Точка b кинетических
Рис.2. Кинетические кривые в координатах рН – t
и e – t при Т = 303 и 313 К
кривых отвечает полному растворению микрофазы. Соответствующее значение
потенциала принимали за ноль отсчета
при любой температуре.
На участке bc кинетической кривой
наблюдается линейный спад потенциала. Это может иметь место лишь в том случае,
если реакция идет по первому кинетическому порядку по Ag+-иону. На
этой стадии, вероятно, происходит также агрегирование первичных кластеров и
формирования частичек значительно большего размера, количество атомов в которых
может отвечать одному из так называемых
«магических» значений».
Первой стадией механизма, по нашему мнению, может
быть образо-вание Ag-фульватного комплекса за счет хелатирования Ag+-иона
о-распо-ложенными ионизированными гидроксигруппами, присутствующими в
молекуле компонента фульвокислотной смеси НnФ. Начальный
отрица-тельный заряд этого компонента уменьшается при этом на единицу.
Дальнейшее формирование первичного металлокластера мы изображаем такой схемой:
Ag+ + Фn– ®[AgФ](n–1)–
[AgФ](n–1)– + 2Ag+ +
2OH– ® Ag20[AgФ(OH)](n–1)– +
H2O
Ag20[AgФ(ОН)](n–1)– + 2Ag+ +
2OH– ® Ag40[AgФ(ОН)2](n–1)– + H2O
. . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
.
Ag (2m)0[AgФ(ОН)m](n–1)– + 2Ag+ +2OH– ®Аg (2m+2)0[AgФ(ОН)(m+1)]n–1 +
H2O
Максимальное значение индекса m зависит от
восстановительной способности
конкретной молекулы фульвокислоты. Кажется также разум-ным предположение, что
скорость роста первичных кластеров будет большей для тех из них, индекс m
у которых больше. Поэтому именно эти
кластеры достигнут предела роста, обусловленного восстановительной способностью
органической компоненты, кластеры же меньшего размера, наоборот, будут
деградировать, высвобождая в среду частично окисленные фульват-анионы и
положительно заряженные первичные кластеры, которые будут принимать участие в
процессе дальнейшей нуклеации, формируя положительно заряженное ядро
наночастицы
Ag (2m+2)0[AgФ(ОН)(m+1)](n–1)– ® [Ag (2m+3)]+
+ [Ф(ОН)(m+1)]n–.
Поскольку
суммарный заряд анионов [Ф(ОН)(m+1)]n– больше заряда
ядра, они за счет сил электростатического притяжения могут покрыть ядро
сплошным слоем, сообщая ему отрицательный заряд. Этот избыточный отрицательный
заряд и обуславливает агрегативную устойчивость образовавшейся наносистемы.
Поливалентные катионы (Сu2+, Pb2+, Cr3+),
вводимые в систему реагируют стехиометрически, переводя в осадок весь
аргентум-фульватный комплекс.
На участке de наблюдается некоторое возрастание
потенциала, которое в рамках предлагаемого механизма пока не имеет разумной
интерпретации. Данные наблюдений за системой, защищенной от контакта с
воздухом, показывают, что окончательная стабилизация рН и установ-ление
равновесного окислительно-восстановительного потенциала проис-ходит
на протяжении довольно продолжительного времени (порядка несколь-ких
десятков часов).
По угловому коэффициенту наклона кинетических кривых к
оси времени были также рассчитаны константы скорости процесса при двух
температурах и определена энергия активации процесса. Она оказалась равной
92.286 кДж/моль.
После
завершения реакции полученный раствор содержит наночас-тицы серебра, о чем
свидетельствует появление в его спектре интенсивной полосы поглощения при длине
волны 400 нм. Данная полоса характерна
для золей с наноразмерными частицами металлического серебра (3 ¸ 8 нм) и обусловлена резонансным
плазмонным поглощением.
Для
определения размеров серебряных нанокристаллов мы выделяли их в твердую фазу
одним из двух способов: химическим осаждением при взаимодействии с
многозарядными катионами (Сu2+, Cr3+, Pb2+ и
др.) или путем замены растворителя. В последнем варианте противоионами,
нейтрализу-ющими отрицательный заряд наночастицы
являются катионы щелочного металла, которые присутствуют в реакционной смеси.
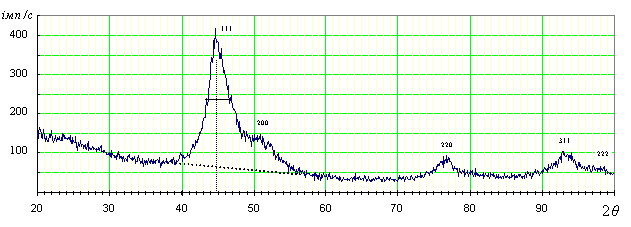
Катионом-осадителем по первому способу в наших опытах был Сu2+-ион. Размер наночастиц в полу-ченных осадках определяли по расширению линий на рентгеновских дифракто-граммах снятых по методу порошка.
Дифрактограммы
снимали на рентгеновском гониометре ГУР-8, фоку-сировка луча в котором осуществляется по
схеме q – 2q. Оценка
размера блоков когерентного рассеяния в осадке проводилась по формуле Шеррера
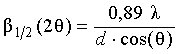
где: ![]() – ширина дифракционной линии на
половине ее высоты
– ширина дифракционной линии на
половине ее высоты
для угла
2θ, рад;
l – длина волны использовавшегося
рентгеновского излучения, Å;
d
– размер кристаллита, Å;
cos(q) – косинус угла при котором
наблюдается дифракционный
максимум .
Рис. 3. Рентгеновская
дифрактограмма наноразмерных кластеров Ag, полученных путем замены
растворителя (вода®ацетон)
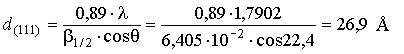
Вычисление, проведенное для длины волны 1,79 Å (Со-анод), дало
размер кристаллита равный 26.9Å или 2.69 нм.
Выводы
1. Показано, что смесь синтетических фульвокислот
полученная окислением гематоксилина, может быть эффективным восстановителем Ag+-ионов
в синте-зе серебряной нанокластерной системы.
2. Исследована кинетика восстановления Ag+-ионов
с участием компонентов фульвокислотной смеси и предложен гипотетический
механизм этой реакции.
3. Для дисперсной фазы,
выделенной из раствора путем замены раствори-теля, определен размер
кристаллитов по уширению линий на рентгеновской дифрактограмме. Расчеты по формуле
Шеррера позволили определить размер блока когерентного рассеяния – 26,9 Ǻ
(2,69 нм), что доказывает существова-ние в исследуемой системе нанорозмерных
кластеров металла.
Литература
1. Баранова
Э.К., Мулюкин А. Л., Козлова А. Н. и др. Взаимодействие ионов и
кластеров
серебра в водных и водно-органических растворах с клетками
Candida utilus и
Saccharomyces cerevisiae // Наукоемкие
технологии, 6, № 5,
2005, С. 103-108.
2. E. J. Rentz Viral
Pathogens and Severe Acute Respiratory Syndrome:
Oligodynamic Ag+ for Direct Im-mune Intervention // Journal of
Nutritional
&
Environmental Medicine (June 2003) 13(2), гг.109–118.
3. Interaction
of silver nano-
particles with HIV1 //J. of
Nanobiotechnology, 2005, 3:6
4. Pat.US
# 6478946, Int.Cl6 C25C
001/00 ; A01N 025/00. Method of
Producing Fulvic, Humic, and
Ulmic Acid for Use as an Electrolyte in
Producing Ionized
Bactereacides from Precious Metals and OrganicAcids
/ Westwood, Kenneth D.; Fil.D. 07.03.2001, Publ.D. 12.11.2002.
5. Pat.US
# 5945446, Int.Cl6 A61K31/35
; A01N 35/78. Process for Preparing
Synthetic Soil-Extract Materials and
Medicaments Based Thereon / Richard
J. Laub;
Fil.D. 10.02.1997, Publ.D. 31.08.1999.
6. Федоренко К.
В., Литвин В. А., Галаган Р. Л. Одержання,
фракціонування
та дослідження кислотно-основних
властивостей синтетичних аналогів фуль-
вокислот // Materiały IV międzinarodowej naukowi-praktycznej konferencji
«Nauka i inowacja», 9, 2008, Przemiśł, -S
58-65.
SUMMARY
The
mix of oxidation hematoxylin products which are analogues of natural fulvic
acid according to their properties is obtained. Possibility of mix usage as a
redusing precursor for silver nanoparticles synthesis in reaction Ag+-ions
reduction is investigated. The mechanism of this reaction is proposed on the
basis of potentiometric studying of kinetics process. The silver particles size
in nanosystem is estimated on the basis of X-ray diffraction analysis for
Sherrer formula. The average size of cogerent scattering block is 2.69
nanometers according to X-ray diffraction.