Экономические науки/ Химия и химические технологии
К.х.н. Сейлханова
Г.А.
Казахский
национальный университет имени
аль-Фараби, Казахстан
Полиэтилениминовые
комплексы ионов металлов
IIA подгруппы
периодической системы
В настоящее время одним из перспективных
направлений в развитии координационной химии является физико-химическое
исследование процессов комплексообразования ионов металлов с
высокомолекулярными лигандами. Известно, что полимерметалические комплексы
(ПМК) ионов щелочноземельных металлов применяются в качестве электропроводящих
материалов при создании энергоемких батарей и аккумуляторов, катализаторов, а
также в процессах водоподготовки для снижения ее жесткости [1-3]. Кроме того, с
научной точки зрения интерес представляет установление составов, устойчивости
образующихся соединений, определение влияния различных факторов на исследуемый
процесс. В работе в качестве полимерного лиганда использован полиэтиленимин
(ПЭИ), обладающий высокой комплексообразующей способностью, вследствие наличия
в его цепи атомов азота-донора электронов.
На рисунке 1 представлены кривые потенциометрического и вискозиметрического
титрования ПЭИ (СПЭИ =3,33∙10-3 осново-моль/л, ![]() , hпр – приведенная вязкость) солями бериллия(II), магния(II), кальция(II), стронция(II) и бария(II). Смешение водных растворов полиэтиленимина
с растворами солей металлов сопровождается понижением рН среды и вязкости
систем, что, вероятно, обусловлено образованием координационных соединений –
полимерметаллических комплексов с выделением протонов. Как видно из рисунка 1,
вязкость систем уменьшается до k=0,5
в системах ПЭИ-Ве2+, ПЭИ-Мg2+, ПЭИ-Са2+
и до k=0,15 у ПЭИ-Sr2+, k=0,25 у ПЭИ-Ва2+ так, как
происходит сворачивание цепей полимера вследствие внутрицепного хелатирования. Дальнейшее
увеличение концентрации металла приводит к росту вязкости системы, что,
вероятно, обусловлено “раскруткой” поликатиона, в результате электростатического
отталкивания одноименных зарядов поликатионов в одной полимерной цепи.
, hпр – приведенная вязкость) солями бериллия(II), магния(II), кальция(II), стронция(II) и бария(II). Смешение водных растворов полиэтиленимина
с растворами солей металлов сопровождается понижением рН среды и вязкости
систем, что, вероятно, обусловлено образованием координационных соединений –
полимерметаллических комплексов с выделением протонов. Как видно из рисунка 1,
вязкость систем уменьшается до k=0,5
в системах ПЭИ-Ве2+, ПЭИ-Мg2+, ПЭИ-Са2+
и до k=0,15 у ПЭИ-Sr2+, k=0,25 у ПЭИ-Ва2+ так, как
происходит сворачивание цепей полимера вследствие внутрицепного хелатирования. Дальнейшее
увеличение концентрации металла приводит к росту вязкости системы, что,
вероятно, обусловлено “раскруткой” поликатиона, в результате электростатического
отталкивания одноименных зарядов поликатионов в одной полимерной цепи.
hпр×102,дл/г
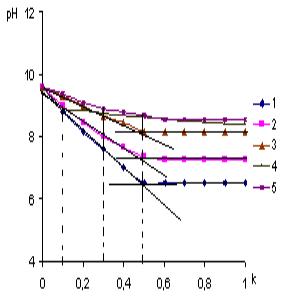
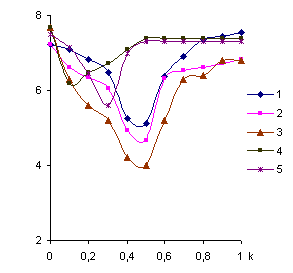
Рисунок
1 - Кривые
титрования ПЭИ солями бериллия(II)(1), магния(II)(2),
кальция(II)(3), стронция(II)(4) и бария (II)(5)
Из кривых титрования найдены оптимальные
мольные соотношения реагирующих компонентов k для каждой системы. В системах ПЭИ – М2+
(Ве, Мg, Са, Sr, Ва) оптимальное мольное соотношением реагентов k=0,5,
т.е. образуется комплексная частица состава N:М=2:1, а в системе ПЭИ – Sr2+ k=0,15 и ПЭИ – Ва2+ k=0,25, что указывает на образование частиц
состава N:Sr=6:1, N:Ва=4:1.
Известно, что на процесс
комплексообразования полимерных лигандов влияют многие факторы: концентрация их
функциональных групп, ионная сила раствора, а также природа индифферентной
соли. Значительное влияние на связывание MX2 (где МХ2-соли
Be(II), Mg(III), Ca(II), Sr(II), Ba(II)) могут оказывать гидрофобные, гидрофильные или
электростатические взаимодействия между компонентами. При образовании
заряженных полимерных цепей в результате взаимодействия с M2+ по мере возрастания степени превращения (комплексообразования)
макромолекула вытягивается. Макролиганд сам может содержать положительно или
отрицательно заряженные атомы, которые либо способствуют, либо мешают его
взаимодействию с ионами металлов [4]. ПЭИ
относится к катионным полимерам, поэтому для нейтрализации электростатического
отталкивания от ионов M2+ в исследуемые растворы вводили хлорид натрия в качестве индифферентного
электролита. Ранее было установлено,
что с увеличением ионной силы раствора от 0,1 до 1,0 электродонорные свойства
иминогрупп ПЭИ повышаются [5], поэтому процессы
комплексообразования исследованы при ионной силе раствора равной 1.
С целью подтверждения составов
образующихся комплексов ПЭИ-M2+ было проведено кондуктометрическое исследование. В
связи с тем, что вязкость системы изменяется в ходе взаимодействия исходных
компонентов, удельная электропроводность была пересчитана на исправленную
электропроводность с учетом вязкости [6]. На рисунке 2 представлена зависимость исправленной
электропроводности от соотношения реагентов. Рост электрической проводимости
обусловлен выделившимися ионами Н+ в ходе реакций между ПЭИ с ионами
указанных металлов. Кроме того, в процессе образования полимерметаллического
комплекса уменьшаются гидродинамические размеры макромолекулы, что, вероятно,
приводит к возрастанию его скорости движения и, как следствие, происходит
увеличение электрической проводимости системы. Как видно из представленного
рисунка, электропроводность растворов с увеличением мольного содержания ионов
металлов проходит через точку перегиба при соотношениях ПЭИ-M2+=2:1; а для систем ПЭИ-ионы стронция(II) и бария(II) еще и при соотношениях, соответственно 6:1 и 4:1.
Анализ указанной зависимости подтвердил факт образования и составы
комплексов, установленных потенциометрическим
и вискозиметрическим методами. С увеличением концентрации в случае ионов
металла стронция и бария, комплексы состава 6:1 и 4:1 переходит, вероятно, в
соединение состава 2:1. Образование соединений состава 2:1 можно объяснить
распадом комплексов состава 6:1 и 4:1, так как избыток ионов металла, вероятно,
приводит к их электростатическому отталкиванию от положительнозаряженных
поликатионов, в результате чего происходит раскручивание макромолекулы и
соответственно изменение состава. Кроме того, при концентрации ионов металла
выше оптимального значения, на макромолекуле, вероятно, образуется максимальное
число положительнозаряженных двойных поликатионов, причем расстояние между ними
по мере добавления соли сокращается, а это в свою очередь приводит к
электростатическому отталкиванию одноименных зарядов.
s×106, См×м-1
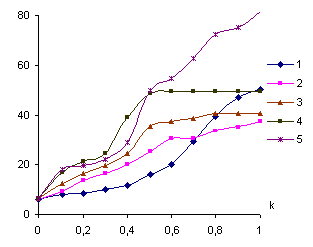
Рисунок
2 - Кривые
кондуктометрического титрования ПЭИ солями бериллия(II)(1), магния(II)(2),
кальция(II)(3), стронция(II)(4) и бария (II)(5)
Согласно результатам эксперимента, с
учетом литературных данных схемы взаимодействия реагентов систем ПЭИ – M2+ (Ве, Мg, Са) можно
предположить следующим образом:
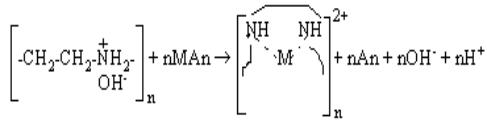
Результаты физико-химических исследований
процессов комплексообразования в системах ПЭИ-Sr2+, ПЭИ-Ва2+
показали, что между компонентами происходит ступенчатое взаимодействие, в
соответствии с предложенной нами схемой:
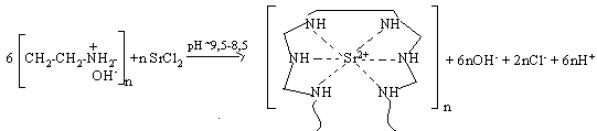
ПЭИ:Sr2+:
1. На первой стадии, вероятно, шесть иминогруппы ПЭИ координированы центральным
ионом комплексообразователем с образованием полимерметаллического комплекса
(ПМК):
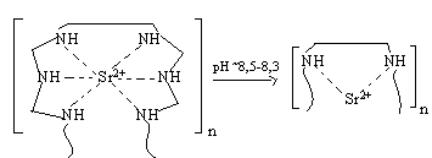
2. На второй стадий, увеличение концентрации ионов металла приводит к
образованию поликатиона состава 2:1:
В низкомолекулярных комплексных соединениях обычно координационное
число иона металла равно 4 или 6. В случае макромолекулярных лигандов могут
образовываться координационные центры состава 1:1, 1:2, 1:3 или 1:4.
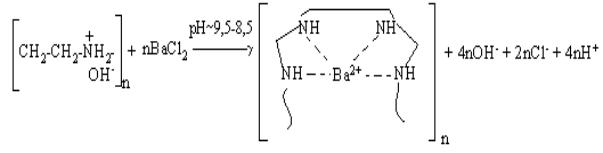
ПЭИ-Ва2+:
1. На первой стадии, вероятно, четыре иминогруппы ПЭИ координированы
центральным ионом комплексообразователем с образованием полимерметаллического
комплекса (ПМК):
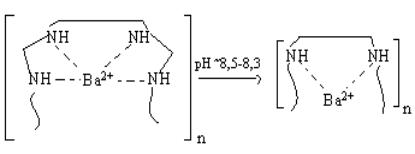
2. На второй стадий, увеличение концентрации
ионов металла приводит к образованию поликатиона состава 2:1:
На второй стадии, вероятно, образуются ПМК
в которых лигандное число иона комплексообразователя (Sr2+, Ba2+) равно двум, а его координационное число может
оставаться неизменным (6 и 4 соответственно) за счет образования
донорно-акцепторной связи с молекулами растворителя или с анионами соответствующих
кислот.
Таким образом, на основании результатов
проведенного физико-химического исследования установлены особенности процессов
комплексообразования ионов металлов IIA подгруппы с ПЭИ, составы образующихся
координационных соединений, а также предложены схемы их формирования.
Литература:
1
Бектуров Е.А. Полимерные электролиты,
гидрогели, комплексы и катализаторы. – Алматы, 2007. – 242 с.
2
Бектуров
Е.А.. Кудайбергенов С., Хамзамулина Р.Э. Катионные полимеры. - Алма-Ата: Наука, 1986. – 169 с.
3
Гембицкий
П.А., Жук Д.С., Каргин В.А. Полиэтиленимин. – М: Наука, 1971. – 203 с.
4 Помогайло А.Д. Полимер-иммобилизованные металлокомплексные катализаторы. – М.: Наука, 1988. – 303 с.
5
Васильев В.П. Термодинамические свойства растворов электролитов. - М.:
Высш. школа, 1982. –
320 с.
6
Усанович
М.И. Опыт химической теории растворов // Сборник трудов II Всес. конф. - Алма-Ата,
1971. - С. 5-18.