Химия
и химические технологии
6. Органическая химия
К.х.н. 1 Валюк В.Ф., к.х.н. 2 Шилін С.В.
1Уманський
державний педагогічний університет
ім. Павла Тичини, природничо-географічний факультет, кафедра агробіотехнологій та хімії,
02003, Україна, Умань, вул. Садова 2, e-mail: Vvalyuk@mail.ru
2 Київський
національний університет імені Тараса Шевченка, хімічний факультет, кафедра
органічної хімії. 01033 Україна, Київ, вул. Володимирська, 64.
Синтез
амідів пептидних похідних кумаринів
Як відомо, одним з обмежень широкого медичного
застосування біологічно активних пептидів є їх чутливість до розщеплення
ферментами організму [1]. Найпростішим методом подолання цього недоліку є N- або C-блокування поліпептидів. Для
захисту С-кінцевої групи синтетичних пептидів часто використовують перетворення
вільної карбоксильної функції сполуки у амідне угруповання і, зокрема, з
використанням вторинних амінів. Зважуючи на сказане, блокування вільної
карбоксильної групи в роботі вели з використанням конформаційно утрудненого
10-гідроксидекагідроізохіноліну 1.
Схема 1.
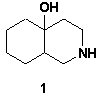
Гетероциклічна система ізохіноліну та його гідрованих
похідних розповсюджена у природі дуже широко. Вона входить до складу багатьох
біологічно активних речовин, наприклад, лікарських препаратів або
алкалоїдів
ізохінолінового ряду, які знайдені у рослинах 30
сімейств. Система декагідроізохіноліну зустрічається у структурах інгібіторів
ВІЛ-протеази, два з яких – саквінавір та нелфінавір одержали дозвіл на
практичне застосування для лікування цієї хвороби [2-3]. Похідні декагідроізохіноліну є антагоністами рецепторів
так званих збуджуючих амінокислот [4-5]. Вони знаходять застосування для
профілактики та лікування цілої низки неврологічних захворювань: церебральної
ішемії, травм спинного мозку, хвороби Альцгеймера, спазмів м’язів, хвороби
Паркінсона, мігрені, хронічних болів і таке інше. Можна припустити, що
включення системи декагідроізохіноліну в структуру пептиду приведе до створення
сполук з новими цікавими біологічними характеристиками.
Реагенти і методи дослідження.
Для синтезу пептидів та кумариніл-пептидів використовували L- та D,L- амінокислоти фірми Реанал
(Угорщина). Температуру плавлення визначали на столі Кофлера. Перебіг реакцій та чистоту одержаних сполук
контролювали методом ТШХ на пластинках Merck 60 F254 у системах хлороформ - метанол (9:1) або (95:5). Спектри ПМР записували
на спектрометрах Varian VXR-300 и Varian Mercury-400 при частоті 300 і 400 МГц
відповідно відносно ТМС (внутрішній стандарт). Результати елементного аналізу
всіх синтезованих сполук відповідали розрахованим величинам.
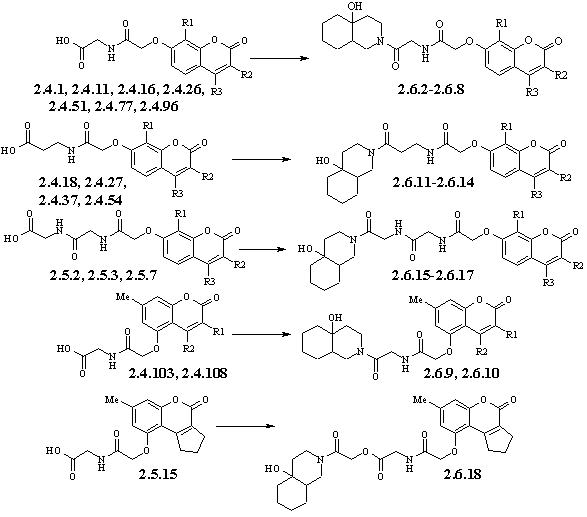
Загальна методика синтезу амідів
амінокислотних та пептидних похідних кумаринів (2.6.2-2.6.18). До розчину 3 ммоль відповідного
амінокислотного або пептидного похідного кумарину і 0.38 г (3,3 ммоль) N-гідроксисукциніміду в 20 мл абсолютного діоксану при
інтенсивному перемішуванні додають 0.52 мл (3.3 ммоль) діізопропілкарбодііміду.
Реакційну суміш витримують при перемішуванні протягом 2 год (хід реакції
контролюють методом ТШХ). До утвореного активованого ефіру додають розчин 0,51
г (3.3 ммоль) 10-гідроксидекагідроізохіноліну в 10 мл абсолютного діоксану.
Суміш перемішують протягом 2-4 год (хід реакції контролюють методом ТШХ). По
завершенню реакції відфільтровують осад діізопропілсечовини, до фільтрата
додають 200 мл води. Утворений осад фільтрують та кристалізують з водного
етанолу.
Реакцію
блокування декагідроізохіноліном вільної карбоксильної групи
кумариніл-амінокислот чи кумаринілпептидів здійснювали N-гідроксисукцинімідним методом в присутності
діізопропілкарбодііміду в якості конденсуючого агенту (схема 2.).
Схема 2.
Література:
1.
Kleinert
H.D. Renin inhibitors: Discovery and development. // Am.
J. Hypertens. – 1989. – Vol. 2, № 8. – P. 800-808.
2.
Ghosh
A.K., Bilcer G., Schiltz G. Synthesis of FDA approved
HIV protease inhibitors. // Synthesis . – 2001, № 15. – P. 2203-2229.
3.
Parkes
K.E.B., Bushnell
D.J., Crackett P.H., et al. Studies toward the large-scale synthesis of the
HIV proteinase inhibitor Ro 31-8959. // J. Org. Chem. – 1994. – Vol. 59, № 13.
– P. 3656-3664.
4.
Anold M.B, Augenstein N.R., Bertsch C.F. et al. Exitatory amino acid receptor antagonists. EP 0590789 B9. – 2003.
5.
Ornstein
P.L., Schoepp D.D., Arnold M.B., et al. 6-Substituted
decahydroisoquinoline-3-carboxylic acids as potent and selective
conformationally constrained NMDA receptor antagonist. // J. Med. Chem.- 1992.
– Vol. 35, № 19. – P. 3547-3560.