Биологические науки/10.
Генетика и цитология
Антонова
Е.И., Бекова Д.И., Хамитова Л.Е., Шпак О.Ю.
Омский
государственный педагогический университет, Россия
Динамика реорганизации
хроматина и показателей клеточного цикла гепатоцитов птиц вида Columba livia в норме и после гипертермии
Усложнение среды обитания в последние годы
актуализировало изучение закономерностей реакции тканевых компонентов печени на
действие неблагоприятных факторов различной природы. Температурный фактор
обеспечивает нормальное развитие, рост, пролиферацию, функционирование и гибель
клеток в системе целостного организма [2]. Среди экстремальных абиотических
факторов среды особое место принадлежит гипертермии. Не редко перегревание
организма птиц может происходить в естественных условиях обитания, например, вследствие
перелетной миграции, когда осуществляется температурозависимый поведенческий
выбор микроклиматов, масштаб которой определяется сезоном года, энергетическими
затратами [14]. Проблема взаимоотношений
организма с окружающей средой включает, прежде всего, изучение тех
приспособительных реакций, с помощью которых
организм и его органы поддерживают гомеостаз, ибо «общая черта всех
компенсаторно-приспособительных реакций состоит
в том, что все они представляют собой ту, или иную комбинацию его физиологических функций» [4]. Сохранение гомеостаза организма после
перегревания достигается путем
реализации различных стратегий метаболизма либо толерантной, либо резистентной. Проявление раннего этапа
компенсаторно-приспособительных процессов на действие повреждающих факторов
наблюдается на субклеточном уровне, отражая становление механизмов развития
тепловой пластичности генотипов в эволюции в зависимости от системы
терморегуляции и экологической специализации. Пространственная организация
генома, радиальное расположение хромосом интерфазных ядер проявляет
тканеспецифичность, эволюционный консерватизм у всех видов животных. Изменения в архитектонике интерфазного
ядра играют важную роль в видообразовании. Известно, что основные регуляторные процессы
реализуются через реорганизацию структуры хроматина, в основе которой лежит
дифференциальное позиционирование различных районов хромосом как относительно
друг друга, так и по отношению к ядерной оболочке, оказывая существенное
влияние на экспрессию генов [11]. Размер генома определяет продолжительность
жизни и биологию организма. Генная плотность растет с
увеличивающимися уровнями некодирующей ДНК. Сложность организации и размер
генома эукариот является адаптивным проявлением
генетического дрейфа в ответ на длительное сокращение размера популяции,
которое сопровождалось увеличением размера организма [13]. Распределение
участков гетеро - и эухроматина в интерфазных хромосомах упорядочено и,
по-видимому, может служить видовым признаком.
В связи с
этим целью
нашего исследования является изучить состояние, количество и топографию
различных фракций хроматина, динамику показателей клеточного цикла, количество
живых и погибших гепатоцитов у птиц вида Columba livia
в условиях физиологической нормы и после действия гипертермии.
Материалы
и методы.
Эксперимент поставлен на 30 половозрелых особях
птиц вида Columba livia (forma domestica) Gmelin, 1789, шести месяцев
постнатального развития. Перегревание проводили в течение 30 минут в
воздуховентилируемой камере при температуре 42°С, температурное воздействие в
заданном режиме приводило к развитию теплового удара средней тяжести [10].
Цитофотометрия
ДНК гепатоцитов
проводилась методом
оптико-структурного анализа (ОСА). Мазки печени окрашивали по Фельгену в модификации
G. Olson, в реактиве Шиффа [3].
На препаратах определяли состояние обоих фракций хроматина (F -
конденсированного, D - деконденсированного): интегральную плотность
– (DI, FI (у.е)), общую
интегральную плотность (TI (у.е)), площадь
распределения (DP, FP (мкм2)),
площадь ядра (ТР (мкм2)), оптическую плотность (DM, FM
(у.е)), среднюю оптическую плотность (T_SR
(у.е)), периметр (DL, FL (мкм)), коэффициент
округлости хроматина (DK, FK
(мкм3)). Согласно
частотному анализу, определяли долю гепатоцитов по фазам клеточного цикла - G0-G1, S, G2+M,
гиподиплоидные.
Измерения параметров ДНК проводились на
сканирующем микроскопе-фотометре «Люмам ПМ-11». В каждой группе у каждого
животного количество ДНК было измерено в 200 ядрах. Во всех случаях исследовали
только одноядерные гепатоциты. Фотографирование и обработка препаратов
проводилась на автоматизированном морфометрическом комплексе «Axioplan» («Carl
Zeiss», Германия).
Статистическая
обработка полученного
материала осуществлена с помощью пакета прикладных программ «STATISTICA-6»
[5]. За критический уровень значимости принимали р=0,05. Определяли
статистические характеристики изучаемых параметров: средняя квадратическая (s),
медиана (Ме), дисперсия (D). Выявляли критерий
согласия χ2 Пирсона, равенство дисперсий σ (Фишера-Снедекора),
согласно которым определяли возможность применения параметрических и
непараметрических методов анализа (критерий Манн-Уитни, Стьюдента). Для
выявления степени сопряженности исследуемых показателей применялся
многофакторный дисперсный анализ MANOVА.
Собственные
данные
В ядрах интактных
гепатоцитов изучаемого вида птиц хроматин в основном представлен
перемежающимися сетчатыми структурами из мелко- и крупнозернистых агрегатов с
различной локализацией (рис. 1).
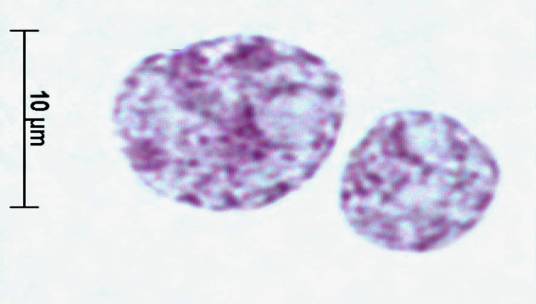
Рис. 1. Ядра
гепатоцитов птиц вида Columba livia.
Контроль. Окраска по Фельгену. Увеличение ок10хоб90. Гетерогенность топографии
хроматина гепатоцитов.
Согласно оптико-структурному
цитофотометрическому анализу параметров Фельген - позитивного ДНК хроматина
гепатоцитов интактных птиц периметр
деконденсированного хроматина (55,1%) больше, чем периметр конденсированного
(44,9%), тогда как коэффициент округлости выше у конденсированного.
Интегральная плотность ДНК выше у эухроматина (54,5%), но средняя оптическая плотность выше у конденсированного
(55,6%). Соответственно площадь распределения диффузного хроматина составляет
71,9%, конденсированного 28,1%. Подобное состояние хроматина отражает наличие в
популяции гепатоцитов 2% гиподиплоидных гепатоцитов; 18% гепатоцитов на стадии S-периода
клеточного цикла; 2,8% на стадии G2-M и 77,2% на
стадии G0-G1 (рис. 2, 3).
|
|
|||
|
|
Выявлено, что
соотношение уровня митотической активности и количества гиподиплоидных
гепатоцитов (G2-M/D) у интактных птиц
составляет 1,4, когда количество гепатоцитов в G2-М-стадии клеточного
цикла превышает количество гиподиплоидных. Соотношение полиплоидизации и
пролиферации (соотношение S/G2-M)
выявило, что из общего количества гепатоцитов в S-стадии только 13,5%
вступают в G2-M-стадию.
После
перегревания птиц топография хроматина в ядрах
гепатоцитов приобретает более гетерогенный вид – выявляются крупнозернистые
агрегаты хроматина с диффузным распределением в объеме ядра; формируются
крупные, ленточной формы нити хроматина (рис. 4).
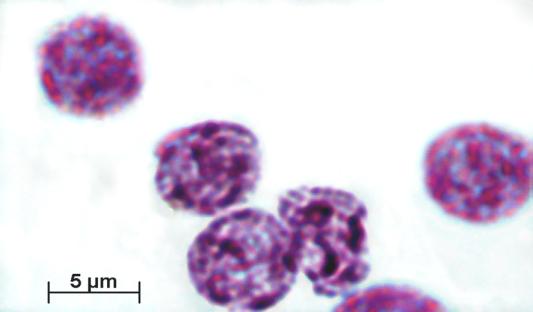
Рис. 4. Ядра гепатоцитов птиц вида Columba livia. Перегревание. Окраска по Фельгену. Увеличение ок10хоб90.
Гетерогенность топографии хроматина. Дифференцированная реакция ядер гепатоцитов
на действие гипертермии.
Выявлено значимое снижение таких показателей,
как периметр конденсированного (на 13,2%) и периметр декондесированного (на
29,4%) хроматина. Уменьшается на 31% площадь распределения диффузного и на
10,3% конденсированного хроматина, а интегральная оптическая плотность
диффузного хроматина в ядре уменьшается на 7%, в то время как конденсированного
на 14,3% увеличивается. Следствием этого является уменьшение на 24,7% площади
ядер в сравнении с контролем. Увеличивается на 33,3% средняя оптическая
плотность диффузного хроматина, конденсированного на 27,3%. Таким образом,
общая оптическая плотность хроматина увеличивается на 29,4%.
После гипертермии отмечается численное
увеличение популяции гиподиплоидных гепатоцитов до 5,25%; снижается число
гепатоцитов в S-стадии до 11,8%, тем не менее, количество гепатоцитов на
стадии G2-М практически не меняется и составляет 2,5%. Отмечается
увеличение числа гепатоцитов в G0-G1 периоде до 80,5% (рис.
5, 6). Соотношение количества пролиферирующих и гиподиплоидных гепатоцитов (G2-M/D),
а также показателей полиплоидизации и пролиферации (S/G2-M)
проявляется в снижении соотношения от 1,4 до 0,5 и от 6,4 до 4,7
соответственно.
|
Рис. 5. Птицы вида Columba livia. Перегревание.
Гистограмма распределения гепатоцитов по клеточному циклу. TI –
интегральная оптическая плотность хроматина. |
|
|
Обсуждение
полученных данных.
Вызываемый гипертермией
каскад структурно-функциональных компенсаций гепатоцитов печени птиц вида Columba
livia на фоне развития как деструктивных, так и
репаративных процессов метаболической модуляции и пролиферативной активности во
многом обеспечивается выявленной нами реорганизацией хроматина [1]. Так, у птиц уменьшение площади распределения эухроматина и
гетерохроматина в ядрах гепатоцитов происходит за счет увеличения уровня их
конденсации,
что, в свою очередь, является определяющим фактором уменьшения площади ядер. Конденсация/деконденсация
хроматина и ядерный размер являются ключевыми параметрами, которые
приспосабливают размер генома к метаболической интенсивности организма после
действия гипертермии [8]. В частности, деконденсация (эухроматизация) в большей
мере затрагивает ДНК в составе гетерохроматина, а, следовательно, может
привести к активации генов, которые обеспечивают включение толерантной стратегии
метаболизма (гипометаболическая,
толерантный гипобиоз), определяя «выживание» гепатоцитов. Выявленное нами переключение стратегий у птиц
с резистентной на толерантную
филогенетически более древнюю, характерную для эктотермных животных,
метаболической основой которой является уменьшение катаболизма, энерготрат и
потребления кислорода отражает то, что новые возможности (функции) в эволюции
возникают на базе уже достигнутого, вызывают активацию эволюционно более
древних механизмов функционирования и энергообеспечения гепатоцитов, для
сохранения мембранных структур гепатоцитов, в частности, митохондрий и
снижение, таким образом, продукции поврежденными митохондриями активных форм
кислорода, как источника нарушений структурной организации гепатоцитов и их
гибели. Следовательно, можно предположить, что при экстремальных состояниях у
эндотермных животных (птицы) могут активизироваться эктотермные механизмы
терморегуляции [12].
Уменьшение площади
распределения ДНК в составе эухроматина и увеличение ее средней оптической
плотности после термального воздействия отражают течение процессов
сверхкомпактизации, что сопровождается снижением биосинтетических процессов в
гепатоцитах, и, следовательно, проявлением переключения стратегий метаболизма с
резистентной на толерантную; развертыванием временнóй генетической
программы клеточной гибели гепатоцитов [8]. Выявленные нами изменения состояния
хроматина, по всей видимости, являются тканеспецифичными показателями и эволюционно
законсервированными [9, 13].
Включение толерантной стратегии также отражает и
состояние тканевого гомеостаза печени птиц [6]. Так как тканевой гомеостаз
поддерживается динамическим балансом в соотношении количества погибших и
пролиферирующих клеток, то выявленное нами увеличение количества гепатоцитов в G0-G1-стадии клеточного цикла
после гипертермии, является защитой генома от повреждающего действия экзогенных
факторов; выявлено уменьшение количества гепатоцитов в S-стадии, а в G2-M-стадии
количество гепатоцитов соответствует норме. После гипертермии увеличивается
количество гиподиплоидных гепатоцитов. И если в условиях физиологической нормы
основной формой регенерации гепатоцитов является полиплоидизация, то после
перегревания наблюдается переключение форм регенерации гепатоцитов с
полиплоидизации на пролиферацию.
На основании
полученных данных о состоянии и количестве различных фракций хроматина в ядрах
гепатоцитов птиц можно сделать заключение – у интактных животных количество
митотически делящихся гепатоцитов превышает количество гиподиплоидных. Основной
формой регенерации гепатоцитов является полиплоидизация. Краткосрочное,
однократное повышение температуры окружающей среды вызывает цитофизиологические
компенсации со стороны хроматина в ядрах гепатоцитов птиц, реализуемые за
счет развития метаболической
депрессии, вследствие переключения стратегий метаболизма с резистентной на
толерантную, которая проявляется в: конденсации обеих фракций хроматина;
уменьшении площади их распределения и площади ядер
гепатоцитов; деконденсации
гетерохроматина. Вследствие выше перечисленного изменяется распределение
популяции гепатоцитов по стадиям клеточного цикла: увеличивается доля
гиподиплоидных гепатоцитов; отмечается блок гепатоцитов в G0- G1 стадии,
снижение доли гепатоцитов в S-стадии
клеточного цикла; наблюдается смена формы регенерации гепатоцитов с
полиплоидизации на пролиферацию
Литература:
1.
Автандилов,
Г.Г. Плоидометрическая диагностика функционального состояния гепатоцитов в
области воздействия плазменного луча [Текст] / Г.Г. Автандилов, М.Д.
Байрамкулов // Научн.-практ. журн. для клиницистов. -2004.- №1.- С. 2-6.
2.
Калашникова,
М. М. Особенности ультраструктуры клеток печени грачей обитающих в экологически
не благоприятной зоне [Текст] / М. М. Калашникова, Е. О. Фадеева // Изв. РАН.
Серия биология. - 2006. - № 2. - С. 133-141.
3.
Козинец, Г.И. Клетки крови. Современные технологии их
анализа [Текст] / Г.И. Козинец, В.М. Погорелов, Д.А. Шмаров, С.Ф. Боев, В.В.
Сазонов.- М.: Триада-Фарм, 2002.- 171с.
4.
Крыжановский, Г.Н. Биоритмы
и закон структурно-функциональной временной дискретности биологических
процессов [Текст] / Г.Н. Крыжановский //
Биологические ритмы в механизмах компенсации нарушенных функций.- М., 1973.-
С.20-34.
5.
Реброва,
О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных
программ STATISTICA [Текст] / О.Ю. Реброва.- М.: МедиаСфера,
2002.- 305 c.
6.
Bennett, M.R. Metabolic gene
regulation in a dynamically changing environment [Тext] / M.R. Bennett, W.L. Pang, N.A. Ostroff, B.L. Baumgartner,
S. Nayak, L.S. Tsimring, J. Hasty // Nature.-
2008. – Vol. 454.- P.1119-1122.
7. Cavalier-Smith, T. Economy,
speed and size matter: evolutionary forces driving nuclear genome
miniaturization and expansion [Тext] / T. Cavalier-Smith // Ann. Bot. (Lond).- 2005.-Vol.95,
№1.-P.147-75.
8. Frampton, J. Postreplication
repair and PCNA modification in schizosaccharomyces
pombe [Тext] / J. Frampton, A. Irmisch, C. M. Green, A. Neiss, M.
Trickey, H. D. Ulrich, K. Furuya, F. Z. Watts, A. M. Carr, A. R. Lehmann // Originally
published as MBC in Press. –
2006. - Vol. 17, №7. – P. 2976-2985.
9.
Kenneth,
N. S. Regulation of gene expression by hypoxia [Тext] / N. S.Kenneth, S. Rocha // Biochem.
- 2008.- Vol. 414 .- P.19–29.
10.
McKechnie, A. E. Partitioning of evaporative water loss in
white-winged doves: plasticity in response to short-term thermal acclimation
[Тext] / A. E. McKechnie,
B. O. Wolf // Exp. Biol. – 2004. – Vol. 207. – P. 203-210.
11.
Parada, L. A. Tissue-specific
spatial organization of genomes [Тext]
/ L. A. Parada, P. G. McQueen, T. Misteli // Genome Biology. – 2004. – Vol. 5. – P. 44.
12.
Sabat,
R.-P.Water and energy economy of an omnivorous bird: Population differences in
the collared Sparrow (Zonotrichia
capensis) [Тext] / R.-P.Sabat ,G. Cavieres , C. Veloso , M. Canals // Comparative Biochemistry and Physiology - Part A: Molecular &
Integrative Physiology.- 2006.- Vol. 144, № 4 .- P. 485-490.
13.
Vinogradov, A. E. Duplicity genic
the collector pf dust is satisfied also with sample CpG concerning expression
in a human genome: size against breadth [Тext] / A. E. Vinogradov // Genet. Tendencies. - 2005.- Vol.21.- P.639-643.
14.
Warren,
P. P. Calculating Climate Effects on Birds
and Mammals: Impacts on Biodiversity, Conservation, Population Parameters, and
Global Community Structure [Тext] / P.
P. Warren, S. Budaraju, W. E. Stewart, N. Ramankutty // American
Zoologist. – 2000. – Vol. 40, № 4. – P. 597-630.