К.х.н. Берлинский И.В.
Санкт-Петербургский
государственный горный университет, Россия.
Влияние термодинамических свойств
лантаноидов цериевой группы на их извлечение методом ионной флотации.
Редкоземельные
элементы (РЗЭ) - а это иттрий и 14 лантаноидов в Периодической таблице
Менделеева от лантана до лютеция, - обладают уникальными свойствами, благодаря
чему используются в различных сферах
современной промышленности, особенно в наукоемких технологиях. В то же
время минеральное сырье относится к числу не восполняемых в природных условиях
ресурсов, его запасы ограничены. А некоторые виды полезных ископаемых нельзя
заменить другим сырьем или технологиями. Поэтому комплексное использование
минерального сырья - важнейшее направление ресурсосбережения в новом тысячелетии.
От него зависит обеспечение потребностей общества в дефицитных, в том числе
стратегических, видах ценных компонентов и сохранение их резерва для будущих
поколений. Для извлечения РЗЭ из растворов выщелачивания рудных концентратов
используют технологии, основанные на физико-химических методах: экстракцию
органическими реагентами, ионный обмен [1,2]. Изучается применение ионной
флотации с поверхностно-активными веществами (ПАВ) [3,4].
Для
установления механизма процессов и прогнозирования оптимальных условий
извлечения и разделения катионов металлов методами экстракции и ионной флотации
необходимо знать рН образования гидроксокомплексов металлов и рН
гидратообразования, которые могут быть рассчитаны на основе энергий Гиббса
образования гидроксокомплексов и гидроксидов металлов.
Значения
рН гидратообразования и образования гидроксокомплексов в растворах солей
нитратов церия, самария и европия в степенях окисления 3+ были определены
методом комбинированного кондуктометрического и потенциометрического титрования.
Вычислены значения констант нестойкости гидроксокомплексов, произведения
растворимости и энергии Гиббса образования гидроксидов. Полученные значения
приведены в таблице 1.
Таблица 1
Результаты экспериментального определения энергий Гиббса
образования гидроксокомплексов и гидроксидов лантаноидов цериевой группы.
|
Соединение |
рН½compl (рНhydr) |
Kn,z (L) |
ΔfG0298, кДж×моль-1 |
ΔcomplG0298, (ΔsG0298) кДж×моль-1 |
|
Ce(OH)2+ |
5,90±0,10 |
(6,80±3,50)×10-9 |
-
879,33±3,40 |
-
46,62±1,65 |
|
Ce(OH)3 |
6,40±0,11 |
(6,43±3,20)×10-27 |
-
1296,91±3,74 |
149,50±1,71 |
|
Sm(OH)2+ |
5,75±0,21 |
(5,04±1,93)×10-9 |
-
866,49±3,60 |
-
47,36±1,21 |
|
Sm(OH)3 |
6,49±0,07 |
(5,03±1,60)×10-27 |
-
1283,93±3,363 |
150,10±0,17 |
|
Eu(OH)2+ |
5,80±0,27 |
(4,92±2,45)×10-9 |
-
782,60±4,90 |
-
47,42±1,71 |
|
Eu(OH)3 |
6,52±0,20 |
(7,17±5,04)×10-27 |
-
1199,11±3,36 |
149,23±3,00 |
Ионную
флотацию лантаноидов изучали из водных растворов нитратов с концентрацией 0,001
моль·кг−1 с помощью додецилсульфата натрия (NaDS).
Исследовалось распределение ионов редкоземельных элементов в системе «водный
раствор - пенная фаза» [5]. С целью нахождения условий наиболее полного
выделения РЗЭ изучена зависимость коэффициента распределения церия, самария и
европия между водной и органической фазами от рН раствора.
Результаты
изучения влияния рН водной фазы на ионную флотацию церия из нитратных сред представлены
на рисунке 1.
Сопоставляя
экспериментальные результаты по ионной флотации с полученными значениями
термодинамических свойств исследуемых лантаноидов и иттрия можно предположить,
что извлечение лантаноидов цериевой группы в процессе ионной флотации
происходит в виде основных солей додецилсульфатов Ln(OH)(С12Н25OSO3)2. В ряду
лантаноидов с ростом порядкового номера наблюдается тенденция к повышению
максимальных значений коэффициента распределения. Это можно объяснить
увеличением ионного потенциала, числа участвующих в образовании связей f-электронов.
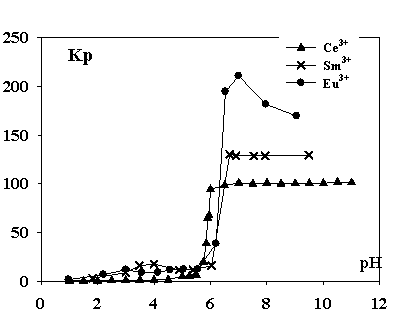
Рис.1.
Зависимость коэффициента распределения Кр ионов Ce3+, Sm3+, Eu3+ от рН раствора.
Максимальное извлечение происходит в области рН
образования гидроксидов, но в ходе эксперимента выпадение осадков не наблюдали,
что можно объяснить образованием в водной фазе устойчивых комплексов
гидроксокатионов с додецилсульфатом.
Литература:
1.
В.В.
Комольцев, Ф.Д. Ларичкин, А.А. Александров Конъюнктура рынка редкоземельных металлов.
/ Цветная металлургия. 2004. №11. С.8-12.
2.
Э.П. Локшин, В.Н. Лебедев, В.М. Маслобоев и др. Фосфогипс из хибинского
апатитового концентрата – реальный источник
редких элементов. // Минеральное сырье. 2000. №7. Т.II. С.122-126.
3.
Grieves R.B., Charewicz W.R. Ion and
colloid flotation of Ni, Co and Pt // Separation Science. 1975. Vol.10. N 1. P.77-92.
4.
Gassett B.B., Otis J.S., Peter F.A.
The Influence of various parameters on foam separation / J.Water Pollution
Control Fed. 1965. V. 37. N 4. p. 460.
5.
Д.Э.
Чиркст, О.Л. Лобачева, И.В.Берлинский Извлечение и разделение ионов Се3+
и Y3+ методом ионной флотации. / Ж. Прикл. Хим. 2009. Т. 82. № 8.
С. 1273 - 1276.