Химия и химические технологии 7. Неорганическая химия
К.т.н. Агеева Е.В., к.т.н. Агеев Е.В., аспирант Сотникова
Д.А.
Юго-Западный государственный университет, Россия
Особенности
жидкофазного окисления гидросульфита натрия в присутствии производных малеиновой
кислоты в бисерной мельнице
Жидкофазное окисление
гидросульфита натрия молекулярным кислородом встречается в процессах получения
жирующих и эмульгирующих составов для обработки кож. Схема получения таких
составов такова: сначала проводят жидкофазное окисление жиров, их смесей с
растительными маслами, последних индивидуально или совместно с иными
композициями промышленного производства в присутствии кобальтового или
марганцевого катализатора, после чего свежеполученный оксидат обрабатывают в
течении определенного времени гидросульфитом натрия чаще всего без прекращения
барботажа воздуха при такой обработке. Роль гидросульфита в таком процессе
многогранна. Ясно, что гидросульфит прежде всего прореагирует с карбонильными
соединениями оксидата с образованием α - оксисульфопроизводных.
Гидросульфит натрия будет реагировать и с непредельными компонентами оксидатов
с образованием солей сульфокислот. Этот процесс цепной радикальный, сопряженный
с окислением компонентов оксидатов обозначенных выше систем, а также и с окислением
самого гидросульфита натрия. Ясно, что прежде чем что-то утверждать, нужно разобраться
с каждым возможным вариантом окисления молекулярным кислородом отдельно, причем
лучше всего на упрощенной индивидуальной модели.
Полученный по реакции:
Nа2SО3 + НСl → NаНSО3 + NаСl
гидросульфит натрия окисляется кислородом воздуха плохо. Даже при использовании
наиболее благоприятного реактора в виде бисерной мельницы вертикального типа со
стеклянным бисером в оптимальном с загрузкой реакционной смеси соотношении на
расходование 1 моль/кг гидросульфита
натрия требуются 1,5 - 2 тыс.мин. Получали натриевую соль малеиновой кислоты
путём нейтрализации последней щёлочью в стехиометрических количествах. Раствор
последней с концентрацией 1,0÷1,4 моль/кг смешивали в объёмном соотношении
1:1 с раствором гидросульфита натрия (1,0-1,5 моль/кг) непосредственно в
бисерной мельнице таким образом, чтобы массовое соотношение загрузки и
стеклянного бисера было 1:1. Далее включали механическое перемешивание, подавали
воздух на барботаж. По ходу процесса отбирали пробы реакционной смеси, в
которых контролировалось содержание гидросульфита натрия, непредельных
соединений и рН. В присутствии Na-соли
малеиновой кислоты расходование гидросульфита натрия существенно замедляется, в
сравнении с окислением гидросульфита натрия в аналогичных условиях, но без
непредельных соединений.
В присутствии непредельных соединений и
окислителя развивается цепное расходование НSO3¯, а
именно
|
НSO3¯
+ MnO2(Mn(OН)О) → ·SO3¯
+ Mn(OН)О(Mn(OН)2) |
|
(1) |
||||||
|
·SO3¯
+ >С=С< → |
|
|||||||
|
|
+
НSO3¯
→ |
|
+ ·SO3¯ |
|||||
|
|
|
|
||||||
|
·SO3¯ |
|
|||||||
Протекание процесса по схеме цепного
превращения (1) должно существенно увеличить скорость расходования
гидросульфита натрия, что хорошо подтверждается на практике (рис. 1).
По ходу протекания рассматриваемого
процесса наблюдается накопление твёрдой фазы продукта. По массе высушенный и
отфильтрованный осадок в отдельных случаях примерно превышает на 10-15% массу
загруженной соли малеиновой кислоты. Данный продукт
легко реагирует с соляной кислотой, превращаясь в компактное полимерное
вещество. В водной фазе остаётся NaCl в достаточно больших количествах. Это
позволило рассматривать полученный продукт как натриевую соль полимерной
малеиновой кислоты с некоторым содержанием NaO3S – групп.
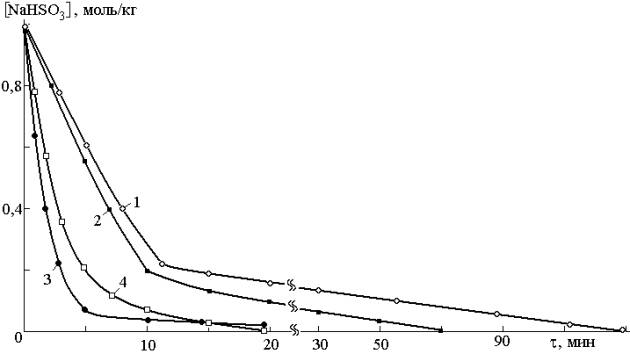
Рис. 1. Кинетические кривые расходования гидросульфита
натрия в присутствии диоксида марганца в количестве 0,4 моль/кг в отсутствие
барботажа воздуха (1, 2) и с
барботажем воздуха (3, 4) без добавок
непредельных соединений (1) и в
присутствии 0,5 моль/кг частично нейтрализованной до рН ~ 6 малеиновой кислоты
(2,3) и 0,9 моль/кг олеиновой кислоты
в виде 50%-ного раствора в изопропиловом спирте (4)
Для оценки количества
последних был использован следующий принцип: если с помощью непрерывного ввода
NaНSO4 в качестве сильной кислоты удержать рН на одном и том же
уровне, то динамика ввода кислоты должна отражать расходование -SO3Na
- групп на сульфирование по двойной связи малеиновой кислоты. Количество же
введённой кислоты в молях должно соответствовать числу молей фрагментов -SO3Na
в продукте. Выполненная указанным способом оценка показала, что мольное
содержание -SO3Na - групп в продукте не превышает 4-7% мол.
Работа
выполнена в рамках реализации ФЦП «Научные и научно-педагогические кадры
инновационной России» на 2009–2013 годы, государственный контракт №
16.740.11.0603 от 30.05.2011 г.