К.х.н. Берлинский И.В., проф.
Чиркст Д.Э., доц. Лобачева О.Л.
Санкт-Петербургский
государственный горный университет, Россия.
Термодинамические свойства иттрия и лантаноидов
иттриевой группы и механизм ионной флотации.
Мировой
спрос на редкоземельную продукцию в последние 20 лет развивается по
возрастающему тренду. Экспорт РЗЭ в составе высокотехнологичных продуктов и
изделий наиболее выгоден, и именно он обеспечивает развитым государствам
максимальную прибыль. Наибольшим
спросом на мировом рынке пользуются индивидуальные редкие земли, они всё шире применяются в высокотехнологических
отраслях экономики, цены на них в десятки раз выше по сравнению с
суммарным продуктом. Для извлечения РЗЭ из растворов выщелачивания рудных
концентратов используют технологии, основанные на физико-химических методах:
экстракцию органическими реагентами, ионный обмен [1-3]. Изучается применение
ионной флотации с поверхностно-активными веществами (ПАВ).
Для
установления механизма процессов и прогнозирования оптимальных условий извлечения
и разделения катионов металлов методами экстракции и ионной флотации необходимо
знать рН образования гидроксокомплексов металлов и рН гидратообразования,
которые могут быть рассчитаны на основе энергий Гиббса образования
гидроксокомплексов и гидроксидов металлов. В современной справочной литературе
[4-7] наблюдаются значительные, в некоторых случаях более 100 кДж·моль-1, расхождения в значениях энергии Гиббса образования гидроксидов и
гидроксокомплексов лантаноидов
или отсутствие этих данных. Уточнение этих величин
необходимо для расчета рН гидратообразования, так как считается, что резкое
возрастание степени извлечения происходит в области рН гидратообразования [8,9].
На этой основе возможны заключения о механизме ионной флотации.
Значения
рН гидратообразования и образования гидроксокомплексов в растворах солей
нитратов эрбия, иттербия и иттрия в степенях окисления 3+ были определены
методом комбинированного кондуктометрического и потенциометрического
титрования. Вычислены значения констант нестойкости гидроксокомплексов,
произведения растворимости и энергии Гиббса образования гидроксидов. Полученные
значения приведены в таблице 1.
Таблица 1
Результаты экспериментального определения энергий Гиббса
образования гидроксокомплексов и гидроксидов лантаноидов иттриевой группы.
|
Соединение |
рН½compl (рНhydr) |
Kn,z (L) |
ΔfG0298, кДж×моль-1 |
ΔcomplG0298, (ΔsG0298) кДж×моль-1 |
|
Y(OH)2+ |
6,3±0,13 |
(1,56±0,72)×10-8 |
- 890,61±4,22 |
- 44,56±1,54 |
|
Y(OH)2+ |
6,97±0,20 |
(7,28±2,31)×10-8 |
- 1088,70±3,99 |
- 40,74±0,68 |
|
Y(OH)3 |
7,20±0,03 |
(1,33±0,28)×10-24 |
- 1297,03±3,97 |
136,28±0,59 |
|
Er(OH)2+ |
5,67±0,19 |
(4,09±1,50)×10-9 |
- 876,16±3,44 |
- 47,88±1,09 |
|
Er(OH)2+ |
6,25±0,06 |
(1,26±0,17)×10-8 |
- 1078,60±3,28 |
- 45,09±0,37 |
|
Er(OH)3 |
6,44±0,02 |
(3,48±0,45)×10-27 |
- 1294,00±3,44 |
151,02±0,34 |
|
Yb(OH)2+ |
5,47±0,14 |
(4,99±1,33)×10-9 |
- 849,17±3,03 |
- 47,39±0,77 |
|
Yb(OH)2+ |
6,30±0,14 |
(1,56±0,45)×10-8 |
- 1050,47±3,22 |
- 43,95±1,35 |
|
Yb(OH)3 |
6,56±0,15 |
(5,66±4,50)×10-27 |
- 1266,74±3,90 |
149,30±2,57 |
Ионную
флотацию лантаноидов и иттрия изучали из водных растворов нитратов с
концентрацией 0,001 моль·кг−1 с помощью додецилсульфата натрия
(NaDS). Исследовалось распределение ионов редкоземельных
элементов в системе «водный раствор - пенная фаза» [10]. С целью нахождения
условий наиболее полного выделения РЗЭ изучена зависимость коэффициента
распределения эрбия, иттербия и иттрия между водной и органической фазами от рН
раствора.
Результаты
изучения влияния рН водной фазы на ионную флотацию церия из нитратных сред
представлены на рисунке 1.
Сопоставляя
экспериментальные результаты по ионной флотации с полученными значениями
термодинамических свойств исследуемых лантаноидов и иттрия можно предположить,
что извлечение в процессе ионной флотации происходит в виде основных солей
додецилсульфатов Ln(OH)2(С12Н25OSO3) и средней соли
додецилсульфата иттрия Y(C12H25OSO3)3.
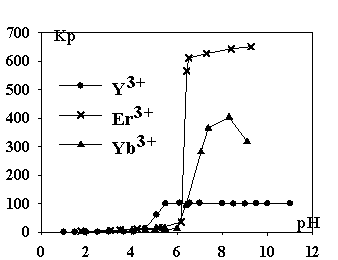
Рис.1.
Зависимость коэффициента распределения Кр ионов Y3+, Er3+, Yb3+ от рН раствора.
Максимальное извлечение происходит в области рН
образования гидроксидов, но в ходе эксперимента выпадение осадков не наблюдали,
что можно объяснить образованием в водной фазе устойчивых комплексов
гидроксокатионов с додецилсульфатом. Иттрий образует менее устойчивые по сравнению с
лантаноидами гидроксосоединения и флотируется в форме среднего додецилсульфата.
Литература:
1.
А.Е. Самонов, Г.Б. Мелентьев «Витамины»
промышленности (перспективы комплексного освоения
эвдиалитовых руд Ловозерского горнопромышленного комплекса). // Химия и Бизнес.
2007. №5. С.36-38.
2.
В.В.
Комольцев, Ф.Д. Ларичкин, А.А. Александров Конъюнктура рынка редкоземельных
металлов. / Цветная металлургия. 2004. №11. С.8-12.
3.
Э.П. Локшин, В.Н. Лебедев, В.М. Маслобоев и др. Фосфогипс из хибинского
апатитового концентрата – реальный источник
редких элементов. // Минеральное сырье. 2000. №7. Т.II. С.122-126.
4.
База данных ТКВ. Параметры и
определения. // http://www.chem.msu.su
5.
Р.А.
Лидин, А.А. Андреева, А.В. Молочко Параметры и определения. Справочник.
Константы неорганических веществ. // Изд. «Дрофа». 2006.
6.
HSC Chemistry Outo Kumpu Research OY
(ver. 4.1.). // Pori. Finland.
7.
I.I. Diakonov, K.V. Ragnarsdottir, B.R. Tegirov Standard
thermodynamic properties and heat capacity equations of rare earth hydroxides:
II. Ce(III)-, Pr-, Sm-, Eu(III)-, Gd-, Tb-, Dy-, Ho-, Er-, Tm-, Yb-, and
Y-hydroxides. Comparison of thermochemical and solubility data. // Chemical
Geology. 1998. 151(1-4).
P.327-347.
8.
B.B. Gassett, J.S. Otis, F.A. Peter
The Influence of various parameters on foam separation / J.Water Pollution
Control Fed. 1965. V. 37. N 4. p. 460.
9.
R.B. Grieves, W.R. Charewicz Ion and
colloid flotation of Ni, Co and Pt // Separation Science. 1975. Vol.10. N 1. P.77-92.
10.
Д.Э.
Чиркст, О.Л. Лобачева, И.В.Берлинский Извлечение и разделение ионов Се3+
и Y3+ методом ионной флотации. / Ж. Прикл. Хим. 2009. Т. 82. № 8.
С. 1273 - 1276.