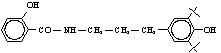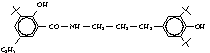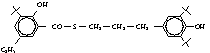К.х.н. Перевозкина М.Г.
ФГБОУ ВПО «Государственного
аграрного университета Северного Зауралья», Россия
Антирадикальная и антиоксидантная
активность новых производных салициловой кислоты
Производные салициловой кислоты нашли широкое применение в медицине в
качестве жаропонижающих, противовоспалительных, анальгезирующих,
противомикробных, антисептических средств. В сельском хозяйстве производные
салициловой кислоты стимулируют ризогенез, ускоряют развитие побегов, защищают
клетки растений от окислительного стресса, осуществляют противовирусную защиту
растений [1,2,3,4]. В последние годы,
среди современных ингибиторов свободно-радикального окисления липидных
субстратов, особый интерес проявляется к полифункциональным фенольным
антиоксидантам. В институте органической химии (НИОХ) им. Н.Н.
Ворожцова СО РАН синтезирована группа замещенных амидов салициловой кислоты,
имеющих в орто- и пара-положении экранирующие трет-бутильные
заместители. Ранее сравнительного тестирования ингибирующих свойств соединений
с целью выявления среди них активных антиоксидантов (АО) не проводилось. Представлялось важным
изучить антиоксидантные свойства новых производных салициловой кислоты в
зависимости от структуры, указать перспективы дальнейшей химической модификации
соединений с рациональной комбинацией нескольких активных группировок.
Возможность дополнительного усиления ингибирующего действия может быть
связана с использованием синергических композиций, при которых эффективность
может быть достигнута при малых концентрациях АО, что особенно важно при
длительном использовании стабилизаторов окисления. Наибольший интерес
представляют смеси с основным природным АО - α-токоферолом (α-ТФ).
Целью в настоящей работе
являлось исследование антирадикальной активности, брутто-ингибирующего действия
новых синтетических фенольных производных салициловой кислоты, установления
взаимосвязи между их строением и антиоксидантной активностью, а также поиск
высокоэффективных синергических композиций при сочетании производных
салициловой кислоты с α-ТФ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Антирадикальную
активность (АРА) соединений тестировали в системе инициированного окисления
этилбензола хемилюминесцентным (ХЛ) методом
совместно с к.х.н. И.Ф. Русиной [5]. Для измерения интенсивности
свечения была использована фотометрическая установка, созданная в ИХФ им.
Семенова РАН. Окисление этилбензола проводили в стеклянной ячейке,
расположенной в светонепроницаемой камере фотометрической установки, снабженной
фотоумножителем ФЭУ-29. Ячейка имела термостатируемую рубашку. Через ячейку
пропускали очищенный от пыли и паров воды воздух. Исследуемое вещество вводили
в окислительную ячейку по ходу реакции с помощью шприцевого устройства.
Излучаемый свет фокусировался на фотоумножитель с помощью системы сферических
зеркал. Окисление инициировали азо-бис-изо-бутиронитрилом (АИБН) в концентрации
3×10-3 М при температуре t=60° С. Скорость зарождения свободных радикалов определяли экспериментально с
помощь реперного ингибитора – хромана С – и составила 2,3´10-8 М´с-1.
Для усиления свечения использовали люминофор 9,10- дибромантрацен в
концентрации 5´10-4 М, не оказывающий влияния на кинетику окисления.
Концентрация ингибитора составляла (1-5)´10-4 М. В ходе эксперимента были получены типичные S-образные кинетические
кривые. Основной кинетической характеристикой ХЛ кривых являлась величина
тангенса угла наклона касательной, проведенной в точке перегиба,
пропорциональная максимальной скорости расходования антиоксиданта [d(I0/I)/dt]max. Указанную величину использовали для расчетов значения k7 с учетом уравнения ![]() , где k6 константа скорости
рекомбинации перекисных радикалов (для этилбензола k6 = 4,1´108 e -2100/RT).
, где k6 константа скорости
рекомбинации перекисных радикалов (для этилбензола k6 = 4,1´108 e -2100/RT).
Из кинетических кривых
ХЛ определяли стехиометрический коэффициент ингибирования f, т.е. число цепей,
гибнущих на одной молекуле антиоксиданта. Значение f оценивали по значению тангенса угла
наклона зависимости периодов индукции от концентрации введенного ингибитора.
Антиоксидантную
активность (АОА) соединений изучали методом поглощения кислорода в манометрических
установках типа Варбурга при окислении модельного субстрата – метилолеата (МО)
в присутствии инертного растворителя хлорбензола [6]. Процесс инициировали за
счет термического разложения при t=600С азобисизобутиронитрила (АИБН),
скорость инициирования в условиях экспериментов составляла 4,2×10-8
М×с-1. Графическим методом определяли величину периода
индукции (ti), представляющей собой отрезок оси абсцисс, отсекаемый
перпендикуляром, опущенным из точки пересечения касательных, проведенных к
кинетической кривой или по формуле: ti
= f [ InH ] / Wi. Действие ингибиторов оценивали величиной
антиоксидантной активности, количественно определяемой по формуле АОА= ti-tS /tS, где tS и ti – периоды индукции окисления субстрата в отсутствие и в
присутствии исследуемого АО соответственно, сравнивали с действием ингибитора,
принятого за стандарт, используя отношение ti / tреп,, где tреп. – период индукции реперного ингибитора. Кинетику накопления
гидропероксидов изучали методом обратной йодометрии при аутоокислении МО при t=60° С в среде хлорбензола.
В качестве реперных ингибиторов использовали a-токоферол и дибунол, при этом концентрации АО были сравнимыми.
Эффективность совместного ингибирующего действия смеси количественно
характеризовали абсолютным значением разности (Dt) периодов индукции окисления МО в присутствии композиции АО (tS ) и простой суммы
индивидуальных компонентов (Sti) (аддитивное действие) (Dt = tS - Sti), либо выражали в относительных единицах – (Dt/Sti)ґ100%. Выполнение неравенства τΣ >Στі
свидетельствовало о проявлении
синергизма в совместном действии компонентов, а τΣ <Στі
- об эффекте антагонизма.
Кинетику расходования
α-ТФ изучали методом УФ-спектроскопии с использованием спектрофотометра Specord М 40 и методом
высокоэффективной жидкостной хроматографии (ВЭЖХ) на хроматографе Милихром А-02
с колонкой Nucleosil 100-5, с детекцией на двухлучевом УФ-спектрофотометре фирмы Carl Zeiss Specord М 40 с автоматизированной
записью и компьютерной обработкой спектров.
Кинетику расходования α-ТФ методом УФ-спектроскопии и ВЭЖХ изучали
совместно с к.ф.-м.н. А.А. Кудрявцевым и к.х.н. Н.Ю. Третьяковым в лаборатории
физико-химических методов исследования Тюменского государственного
университета.
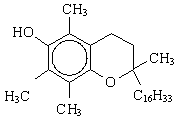
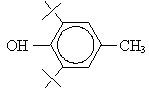
В работе были
использованы α-ТФ (6-гидрокси-2,5,7,8-тетраметил-2-фитилхроман) (Serva,
Германия), дибунол (1-гидрокси-2,6-ди-трет-бутил-4-метил-бензол) (Serva,
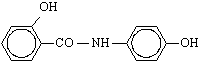
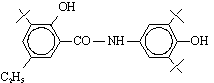
Германия). Производные салициловой кислоты: амид 1-(N-4¢-гидроксифенил) салициловой кислоты (осалмид), амид 1-(N-4¢-гидроксифенил-3,3´,5´-три-трет-бутил)-5-этил
салициловой кислоты, амид 1-(N-4¢-гидроксифенилпропил-3´,5´-дитри-трет-бутил)-5-этил
салициловой кислоты, амид 1-(N-4¢-гидроксифенилпропил-3,3´,5´-три-трет-бутил)-5-этил
салициловой кислоты, сульфид 1-(N-4¢-гидроксифенилпропил-3,3´,5´-три-
трет-бутил)-5-этил салициловой кислоты, пара-ацетаминофенол
(парацетамол) синтезированы в Институте органической химии им. Н.Н. Ворожцова
СО РАН. Чистоту соединений контролировали методом высокоэффективной жидкостной
хроматографии с использованием упомянутого оборудования. При регистрации
хроматограмм использовался режим градиентного элюирования с использованием
воды, метанола и ацетонитрила. Скорость подачи: 100 мкл/мин. Объём кюветы 1,2
мкл. Содержание основного вещества составляло 99,9 %. В качестве субстрата
окисления применяли метилолеат, синтезированный в НИОХ СО РАН, дважды очищенный
путем вакуумной перегонки в токе аргона при 105 °С (чистота МО после перегонки-99,8 %). Растворителями служили ацетонитрил марки «осч» и хлорбензол, очищенный
методом простой перегонки.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В табл. 1 показаны
формулы исследуемых соединений, представляющих собой амидные или сульфидные
производные салициловой кислоты. Большинство из указанных соединений содержат орто-трет-бутильные
заместители и являются пространственно затрудненными фенолами. Считали
целесообразным изучить АРА и сопоставить с известными ингибиторами окисления a-ТФ и дибунолом.
Методом
хемилюминесценции в группе исследуемых соединений была оценена величина
константы скорости реакции k7 АО с пероксильными
радикалами (реакция 7, согласно общепринятой схемы) [7].
RO2• + InH ¾¾® ROOH + In• (7),
где InH – ингибитор окисления, In• - радикал ингибитора, RO2•- пероксильный радикал. Определен фактор ингибирования f,
показывающий количество свободных радикалов, реагирующих с молекулой ингибитора
(табл.1). При исследовании кинетики изменения интенсивности ХЛ в присутствии
исследуемых соединений было установлено, что все АО оказывают ингибирующее
действие на процесс окисления модельного субстрата. Показано, что наибольшую
активность в реакции с пероксильными радикалами из производных салициловой
кислоты проявляет осалмид (табл.1), аномально высокая константа скорости
реакции k7 которого обусловлена наличием p-р-сопряжения между
амино-группой и фенолом. Анализ значений констант скорости реакций k7 структур, отличающихся степенью экранированности ОН-группы, показывает,
что введение экранирующих заместителей приводит к существенному снижению
антирадикальной активности АО (табл.1). Сопоставление антирадикальной
активности исследуемых нами аминофенолов, у которых амино-группа находится на
разном удалении от бензольного кольца, показывает, что по мере удаления этих
групп, а, следовательно, снижения возможности p-r-сопряжения,
значение константы снижается вдвое (табл.1).
Таблица 1
Кинетические характеристики АО различного химического
строения
|
№ п/п |
Название Фенола |
Формула Соединения |
К7´104, М-1´с-1 |
f |
Период
индукции, мин *(САО =2´104 М) |
|
I |
Пара-ацетамино-фенол
(Парацетамол) |
|
4,00±0,13 |
2,4 |
220±4 |
|
II |
Амид 1-(N-4¢-гидрокси-фенил) салициловой кислоты (Осалмид) |
|
6,86±0,15 |
2,4 |
110±2 |
|
III |
Амид 1-(N-4¢-гидроксифенил-3,3´,5´-тритрет. бутил)-5-этил салициловой
кислоты |
|
1,69±0,04 |
2,6 |
220±3 |
|
IV |
Амид 1-(N-4¢-гидроксифенилпропил-3´,5´-дитритрет. бутил)-5-этил салициловой кислоты |
|
0,52±0,02 |
3,3 |
240±4 |
|
V |
Амид 1-(N-4¢-гидроксифенилпропил-3,3´,5´-тритрет.бутил)-5-этил
салициловой кислоты |
|
0,85±0,03 |
3,6 |
240±3 |
|
VI |
Сульфид 1-(S-4¢-гидроксифенилпропил-3,3´,5´-тритрет.бутил)-5-этил
салициловой кислоты |
|
0,74±0,02 |
4,5 |
230±3 |
|
VII |
a-токоферол (6-гидрокси-2,5,7,8-тетраметил-2-фитилхроман) |
|
360±0,12 |
2,0 |
160±2 |
|
VIII |
2,6-дитрет.
бутил-4-метил фенол (дибунол) |
|
1,40±0,02 |
2,0 |
190±2 |
*- С (АИБН) = 3´10-3 M, t=60 °С, – условия окисления метилолеата,
p≤0,05
Таким образом, наиболее
тесная взаимосвязь существует между значением константы скорости реакции k7 и природой заместителя в пара-положении. Полученные нами данные о
характере влияния заместителей разной природы согласуются со сведениями,
приводимыми в известных монографиях и обзорах [8-13].
Сравнение констант
скорости реакции k7 исследуемых фенолов и a-ТФ показывает, что основной природный АО более активен в реакции с
пероксильными радикалами (практически в 360 раз). Стехиометрический фактор
ингибирования f для большинства изучаемых соединений был близок или равен 3 (табл. 1).
Таким образом,
приведенные данные показывают, что механизм действия исследуемых АО связан с
уничтожением пероксильных радикалов, ведущих процесс окисления.
Величина константы
скорости реакции k7 является важной характеристикой ингибирующего
действия АО, но наиболее полное представление об участии ингибитора в сложном
многостадийном процессе окисления можно получить только на основании данных об
антиокислительной активности соединения.
Известно, что для
большинства синтетических АО имеет место положительная корреляционная связь
между концентрацией АО и величиной периодов индукции. В последние годы
показано, что для ряда природных АО указанная зависимость может отклоняться от
прямолинейности в области высоких концентраций [6, 14, 15]. В связи с этим для
исследуемых АО считали важным изучить характер изменения бруто-эффективности от
их содержания в субстрате. Ингибирующее действие всех указанных соединений
тестировалась в широком диапазоне концентраций (5,0´10-5 –
2,5´10-3 М) и сравнивалось с действием известных АО - дибуном, a-ТФ. Было показано, что
исследуемые АО увеличивают периоды индукции окисления модельного субстрата МО.
На рис. 1 а приведены кинетические кривые окисления МО в присутствии равных
концентраций различных АО. Для всех синтетических антиоксидантов наблюдалась
линейная зависимость между периодом индукции и концентрацией. Действие a-ТФ описывается
экстремальной зависимостью (рис. 1б), характер которой ранее был описан в
литературе [6] и воспроизведен в нашей работе. Из рис. 1б видно, что периоды
индукции при ингибировании α-ТФ нарастают до концентрации 2,5´10-3
М, свыше которой происходит постепенное снижение эффективности торможения
процесса.
Этот факт объясняется,
по всей вероятности, различиями в активности феноксильных радикалов АО разного
строения. Известно, что пространственно незатрудненные феноксилы проявляют
высокую активность в побочных реакциях продолжения цепей, приводящих к снижению
действия АО [11].
Показано, что у осалмида
антиоксидантная активность по сравнению с парацетамолом снижается в 2 раза, а
брутто-ингибирующая активность экранированных фенолов выше практически в 2 раза
пространственно незатрудненных АО (табл.1). Сопоставление между собой ряда
структур: амидов салициловой кислоты (III,IV,V) (табл.1) показывает, что разделение между собой
тремя метиленовыми группами амидного и фенольного фрагментов молекулы приводит
к повышению брутто-ингибирующего действия АО. Очевидно, этот эффект связан с
отсутствием p-р-сопряжения
между амино-группой и бензольным ядром. В литературе были получены аналогичные
закономерности для других групп соединений [13,16]. Было установлено, что
структуры (V,VI) близки по своему антиоксидантному действию (табл. 1). Особо необходимо
отметить, что ОН-группа, расположенная по соседству в орто-положении к
карбоксильной – СООН -
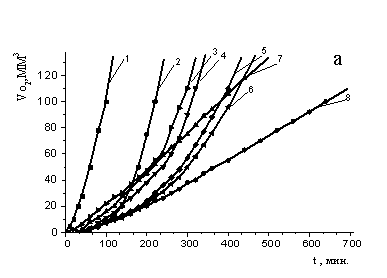
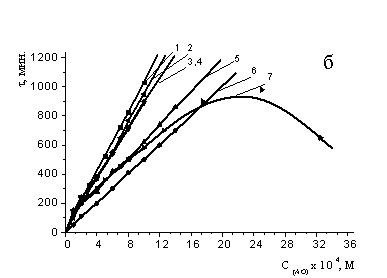
Рис 1а) Кинетические кривые поглощения кислорода МО в
среде хлорбензола в присутствии АО: 1 – контроль; 2 -a-ТФ; 3 дибунол; 4 - амид
салициловой кислоты (III); 5 - амид салициловой кислоты (IV); 6 - амид салициловой
кислоты (V); 7 – осалмид; 8 - парацетамол. С АО = const = 2´10-4 М, С (АИБН) = 3´10-3 M, t = 60°С;
б) Зависимость периодов индукции от концентрации АО:
1 – парацетамол; 2-дибунол; 3- амид салициловой кислоты (V); 4 - амид салициловой
кислоты (IV); 5 - амид салициловой кислоты (III); 6- осалмид; 7 - a-ТФ. С (АИБН) = 3´10-3 M, t=60°.
группе,
независимо от степени
ее экранирования, не вносит существенного вклада в эффективность
ингибирования - периоды индукции сравнимы (табл. 1). На основе полученных
данных можно рекомендовать осуществление синтеза потенциальных АО, у которых
экранированная фенольная ОН-группа должна находиться в пара-положении к
амидной группе, что исключит возможность образования внутримолекулярной
водородной связи. Направленный синтез указанных соединений позволит создать
новую группу высокоэффективных ингибиторов окисления.
Легко заметить, что
ингибиторы гибридной структуры либо близки (II,III), либо превосходят (I,IV,V,VI) по своему действию
природный АО - a-ТФ, а структуры (I,V,VI) соизмеримы с
эффективностью дибунола (табл. 1, рис. 1 а.б).
В работе была
проанализирована закономерность изменения начальной (Wo2 нач) и максимальной (Wo2 max ) скорости окисления при окислении МО в присутствии различных концентраций
изучаемых АО. Изучение показало, что указанные кинетические параметры
практически не изменяются с ростом концентрации дибунола и α-ТФ, но существенно
уменьшаются при введении ингибиторов, содержащих амино-, амидную или сульфидную
группы. (табл. 1). По всей вероятности, выявленная закономерность связана с
участием аминофенолов, амидных и сульфидных производных салициловой кислоты в
реакции нерадикального разрушения гидропероксидов. Для подтверждения гипотезы о
возможном разрушении гидропероксидов под действием гибридных АО были проведены
эксперименты по прямому тестированию кинетики накопления гидропероксидов (ROOH)
после введения в частично окисленную линолевую кислоту (ЛК) каждого из
исследуемых АО (рис. 2). Из рис. 2 видно, что влияние всех АО было однотипным:
после внесения ингибитора в течение первого часа наблюдалось снижение
концентрации гидропероксидов практически до исходного уровня, который в дальнейшем не возрастал в течение всего
периода наблюдений (8 часов). В контроле пероксиды продолжали накапливаться. По
масштабу разрушения гидропероксидов исследуемые АО были сравнимы между собой,
однако, у парацетамола указанные свойства были наиболее выражены. Установлено,
что все исследуемые соединения способствуют разрушению гидропероксидов на
70-75%.
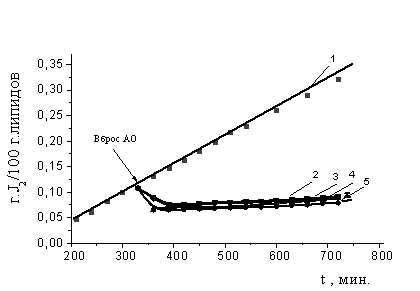
Рис. 2 Кинетика
разрушения гидропероксидов при аутоокислении ЛК в присутствии равных
концентраций АО: 1- контроль, 2 - амид салициловой кислоты (III), 3 - амид салициловой
кислоты (IV), амид салициловой кислоты (V), 4 – осалмид, 5 – парацетамол. Стрелкой показан
вброс АО. С (АО)=соnst=2´10-4M, t=60° C.
Следовательно,
исследуемые соединения в процессе окисления способны как эффективно уничтожать
пероксильные радикалы, так и разрушать гидропероксиды молекулярным путем.
Вероятно, что антирадикальная активность ингибиторов обусловлена присутствием в
их химической структуре фенольного гидроксила, а способность разрушения
гидропероксидов связана с наличием амино-, амидной или сульфидной группы.
В настоящей работе кроме
простого скрининга активных антиоксидантов среди новых структур предпринят
поиск синергических композиций с природным ингибитором α-ТФ. Была
исследована кинетика радикальных реакций в системах, одним из компонентов
которых был a-ТФ, а вторым –
один из пространственно затрудненных фенолов - (V), (VI). В исследуемых композициях
изменяли абсолютные количества и соотношения компонентов. При этом
количественно оценивали действие индивидуальных АО и их бинарные смеси.
Действие смеси АО сравнивалось с их прогнозируемым аддитивным эффектом,
проявляющимся при использовании ингибиторов порознь (табл 2). Показано, что
совместный ингибирующий эффект АО значительно превышает простую сумму периодов
индукции индивидуальных компонентов, что свидетельствует о проявлении в их
совместном действии эффекта синергизма.
Были получены сложные
бимодальные кривые (рис. 3), при анализе которых видно, что смесь АО
значительно более эффективна в области низких концентраций, с ее увеличением
действие компонентов приобретает антагонистический характер (7,0-20,0)ґ10-4 М. Так, оптимальная область концентраций АО соответствует
интервалу (1,0-5,0)ґ10-4 М (рис.3), для a-ТФ – концентрации (2,5-5,0)´10-4 М (табл.2). При этих концентрациях АО обеспечивается
наибольший синергический эффект, равный 50 - 55 %.
Таблица 2
Зависимость величины синергического
эффекта от концентрации a-ТФ и АО субстрат окисления МО, С (АИБН) = 3´10-3 M, t=60 °С
|
№ п/п |
С(АО)´10-4, М |
tинд AO, мин |
Sti, мин |
tΣ, мин |
Dt,мин |
(Dt/Sti)´100% |
|
АО (V*) + С (a-ТФ) = const = 2,5´10-4 М, tинд = 190 мин |
||||||
|
1 |
1,0 |
150±2 |
340 |
435±4 |
95 |
27,9 |
|
2 |
2,0 |
240±4 |
430 |
610±5 |
180 |
41,9 |
|
3 |
4,0 |
380±5 |
570 |
855±6 |
285 |
50 |
|
4 |
6,0 |
550±4 |
740 |
815±7 |
75 |
10,1 |
|
5 |
8,0 |
720±6 |
910 |
770±6 |
-140 |
-15,4 |
|
6 |
10,0 |
900±7 |
1090 |
900±11 |
-190 |
-17,4 |
|
a-ТФ + С (V*) = const = 2´10-4 М, tинд = 240 мин |
||||||
|
1 |
2,5 |
190±3 |
430 |
610±4 |
180 |
41,9 |
|
2 |
5,0 |
300±5 |
540 |
830±6 |
290 |
53,7 |
|
3 |
12,5 |
650±6 |
890 |
1370±12 |
480 |
53,9 |
|
АО (VI*) + С (a-ТФ) = const = 2,5´10-4 М, tинд = 190 мин |
||||||
|
1 |
1,0 |
160±2 |
350 |
455±5 |
105 |
30,0 |
|
2 |
2,0 |
230±3 |
420 |
605±6 |
185 |
44,0 |
|
3 |
4,0 |
390±3 |
580 |
900±7 |
320 |
55,2 |
|
4 |
6,0 |
560±4 |
750 |
860±6 |
110 |
14,7 |
|
5 |
8,0 |
730±5 |
920 |
830±5 |
-90 |
-9,9 |
|
6 |
10,0 |
910±6 |
1100 |
1260±9 |
-160 |
-14,5 |
|
a-ТФ + С (VI*) = const = 2´10-4 М, tинд = 230 мин |
||||||
|
1 |
2,5 |
190±3 |
420 |
610±4 |
190 |
45,2 |
|
2 |
5,0 |
300±5 |
530 |
830±6 |
300 |
56,6 |
|
3 |
12,5 |
650±6 |
880 |
1360±12 |
480 |
54,5 |
*- номер антиоксиданта соответствует таблице 1.
Эффект синергизма для смесей a-ТФ с исследуемыми фенолами связан со способностью АО разрушать
гидропероксиды без образования радикальных продуктов. Тем самым исключается
дополнительный путь расходования a-ТФ. Необходимо отметить, что сопоставимые эффекты ингибирования, сравнимые
с максимальным действием синергической композиции, могут быть достигнуты при
использовании индивидуального АО в концентрациях в 2-5 раза больших, чем в
синергической смеси.
Механизм эффектов
синергизма сводится, по всей вероятности, к следующему. В состав синергической
композиции входит a-ТФ, представляющий собой фенол с высоким значением k7 (PhOH I) и пространственно затрудненный АО (PhOH II) (V,VI), антирадикальная активность которых существенно
ниже. Однако, при окислении a-ТФ образуются
достаточно активные токофероксильные радикалы [17,18,19], а при окислении
экранированных фенолов - неактивные феноксилы [11,20]. На начальных стадиях окисления преимущественно
расходуется более активный АО, но образующиеся при его окислении токофероксилы
быстро обмениваются водородом с экранированным фенолом по реакции, равновесие
которой сильно смещено вправо:
PhO· I + PhOH II « PhOН I + PhO· II
Таким образом происходит
регенерация активной фенольной формы a-ТФ.
Восстановленная форма более активного АО способна вновь обрывать цепи окисления
по реакции:
PhOH + RO2· ¾¾® ROOH + PhO·
Феноксилы PhO· II вследствие своей малой активности в дальнейшем практически не участвуют в
цепном процессе.
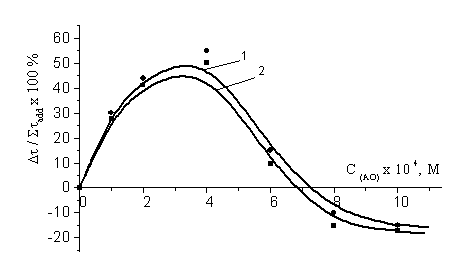
Рис 3. Зависимость эффекта синергизма в композиции a-ТФ + соединение (V) (1), a-ТФ + соединение (VI) (2) от концентрации
АО.
С (a-ТФ)=соnst=2,5´10-4М. С (АИБН) = 3´10-3 M, t=60°С.
Объяснение эффекта
антагонизма при высоких концентрациях ингибиторов связано, по всей вероятности,
с участием феноксилов в побочных процессах с RH, O2, за счет распада
образующихся хинолидных пероксидов. Указанные побочные реакции с ростом
концентрации АО могут увеличивать скорость инициирования и снижать
эффективность действия ингибиторов, приводить к эффекту антагонизма в
совместном действии АО. Возможно также, что эффект антагонизма обусловлен
межмолекулярными взаимодействиями между a-ТФ и природными хинонами, что приводило к уменьшению количества активной
фенольной формы a-ТФ и снижению эффективности совместного действия смеси. Все же роль этих
реакций в исследуемой нами системе не ясна и требует дополнительных
исследований.
Закономерности изменения
скорости расходования α-ТФ изучали методом УФ-спектроскопии. α-ТФ
имеет характерную длинноволновую полосу поглощения при 295 нм, которая в
дальнейшем будет использоваться для фотометрического определения его
концентрации. Ее коэффициент экстинции составляет 2900 дм3/М×см
в ацетонитриле. Присутствие МО, антиоксидантов и инициатора в выбранных концентрациях
не мешало определению концентрации α-ТФ. Дополнительно в кювету сравнения
на двухлучевом спектрофотометре помещался раствор МО и антиоксиданта в той же
концентрации, что и в реакционной смеси. В результате спектрофотометр
регистрировал поглощение света, обусловленное только α-ТФ и продуктами его
трансформации. Инициатор АИБН практически не оказывал влияние на измерения
поглощения в области 295 нм. Поэтому он не добавлялся в кювету сравнения, тем
самым предотвращался химический процесс по радикальному механизму в кювете
сравнения.
Рисунок 4 показывает,
что интенсивность полосы поглощения α-ТФ с течением реакции уменьшается и
увеличивается оптическая плотность поглощения продуктов окисления в
коротковолновой (230 нм) и длинноволновой (340 нм) частях спектра. В спектрах
исходных веществ антиоксидантов и МО практически отсутствовало поглощение в
области 340-400 нм, характерное для свободных радикалов. Обычно в этой области
наблюдается поглощение, связанное с переносом заряда внутри молекул. Слабое поглощение
в этой области наблюдалось только для АИБН. При использовании в реакционной
смеси соединений (V) и (VI) расходование α-ТФ замедлялось. Для выбранных концентраций
реагентов изменение концентрации α-ТФ в композиции с АО оказалось меньшим
по сравнению с композицией, где АО отсутствовали (рис.5). Таким образом,
полученные результаты свидетельствуют, что эффект синергизма обусловлен
снижением расходования α-ТФ в присутствии синтетических АО.
Методом ВЭЖХ была
исследована динамика концентраций антиоксидантов в реакционных смесях в
процессе окисления субстрата. При регистрации хроматограмм использовался режим
градиентного элюирования с использованием ацетонитрила, воды и метанола.
Хроматографический пик α- ТФ имел время выхода около 20 мин. и с течением
времени наблюдалось
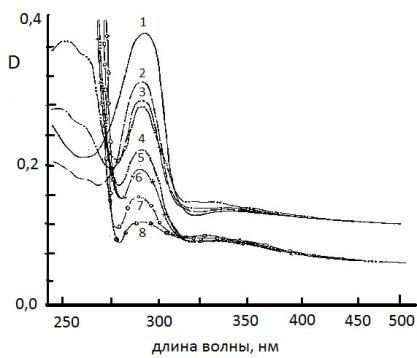
Рис. 4 Спектры
оптической плотности смеси a-ТФ (2,5×10-4М)
+ метилолеат (2,0×10-2М) + АИБН (3,0×10-3М) +
соединение (V) (2,5×10-4М) в ацетонитриле в процессе окисления t=60оС, слой 0,1 см, промежуток между регистрацией спектров 1
час. Раствор сравнения: метилолеат (2,0×10-2М) + соединение (V) (2,5×10-4М)
в ацетонитриле.
уменьшение высоты пика. Это однозначно подтверждало
выводы спектрофотометрических исследований, что концентрация α-ТФ в
процессе окисления композиции снижается. На хроматограмме выделяли пик другого
АО (V) или (VI), снижение его концентрации в процессе окисления композиции идет медленно.
К концу процесса расходования α-ТФ изменение пика соединения (V,VI) составляло всего лишь 10-15 %. На основе данных методов УФ-спектроскопии
и ВЭЖХ были построены кинетические кривые для одной исходной концентрации
α-ТФ (2,5×10-4М) и их наклон очень сильно зависит от
концентрации АО. Установлено, что все кинетические зависимости имеют линейный
характер. При увеличении концентрации АО скорости расходования α-ТФ
падают. Так, при концентрации антиоксидантов
2,5×10-3М α-ТФ расходуется полностью за 8 часов, а
при концентрации АО 2,5×10-5 всего за 3 часа.
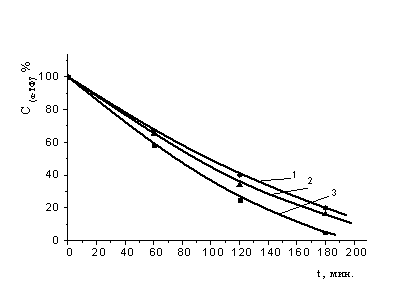
Рис. 5. Кинетика расходования a-ТФ по данным УФ –
спектроскопии при инициированном окислении МО в присутствии: 1 - смеси a-ТФ (2,5×10-4
М) + соединения (VI) (2,5×10-5 М); 2 - смеси a-ТФ (2,5×10-4М)
+ соединения (V) (2,5×10-5 М); 3 - a-ТФ (2,5×10-4М).
С (АИБН) = 3´10-3 M, t=60°С.
Таким образом,
приведенные данные показывают перспективность совместного применения
экранированных фенолов и α-ТФ с целью разработки на основе синергической
композиции новых высокоэффективных способов стабилизации процессов окисления.
На основе полученных данных можно рекомендовать осуществление синтеза потенциальных
антиоксидантов, у которых экранированная фенольная –ОН-группа должна находиться
в пара-положении к амидной группировке, что исключит возможность
образования внутримолекулярной водородной связи. Полученные результаты могут
служить методологической основой для оценки комплексного действия смесей,
перспективных для стабилизации окисления пищевых и биологически активных
липидов, лекарственных препаратов, косметических средств. Исследуемые АО
малотоксичны и могут использоваться в селекции растений, пищевой технологии,
медицине, косметологии.
СПИСОК ЛИТЕРАТУРЫ
1. Васюкова Н.Н., Озерецковская О.Л. Индуцированная устойчивость растений и
салициловая кислота // Прикладная биохимия и микробиология. 2007. Т. 43. № 4.
С. 405-411.
2. Алимбаева А.С., Жакина А.Х., Газалиев А.М., Нуркенов
О. А. Синтез и биологическая активность некоторых производных гидразида
салициловой кислоты // Известия НАН РК. Серия химия. - №6. - 2007. - C. 82-85.
3. Рахманкулова З. Ф., Федяев В. В., Рахматуллина С. Р., Иванов С. П., Гильванова И. Р., Усманов И. Ю. Влияние предпосевной обработки семян пшеницы салициловой кислотой на её эндогенное
содержание, активность дыхательных путей и антиоксидантный баланс растений // Физиология растений. Т. 55. № 4. С.
620-623.
4. Дмитриева С.А., Пономарева А.А., Минибаева Ф.В., Гордон Л.Х. АФК и
протон-опосредованное действие салициловой кислоты на рост и ультраструктуру
клеток корня пшеницы // Учен. Зап. Казан. Ун-та. Сер. Естеств. Науки. 2008. Т.
150. С. 123-135.
5. Русина И.Ф. Хемилюминесцентные методы в исследовании ингибиторов окисления.
Автор. …канд. хим. наук. М.: Институт химической физики им. Н.Н. Семёнова РАН,
2011. 22 с.
6. Сторожок Н.М. Межмолекулярные взаимодействия компонентов природных липидов
в процессе окисления. Дис. . . . д-ра хим. наук. М.: Институт биохимической
физики им. Н.М. Эмануэля РАН. 1996. 360 с.
7. Семёнов Н.Н. Цепные реакции. Л.: Госхимтехиздат, Лен. Отделение. 1934. 555
с.
8. Бурлакова Е.Б., Алесенко А.В., Молочкина А.М. Биоантиоксиданты в лучевом
поражении и злокачественном росте. М.: Наука, 1975. 214 с.
9. Денисов Е.Т. Константы скорости
гомолитических жидкофазных реакций. М.: Наука, 1971. 711 с.
10. Рогинский В.А. Кинетика окисления эфиров
полиненасышенных жирных кислот, ингибированного замещенными фенолами // Кинетика и катализ. 1990. Т.31. С.
546-549.
11. Рогинский В.А. Фенольные антиоксиданты. М.: Наука, 1988. 247 с.
12. Эмануэль Н.М., Денисов Е.Т., Майзус З.К. Цепные реакции окисления
углеводородов в жидкой фазе. М.: Наука, 1966. 375 с.
13. Зенков Н.К., Кандалинцева Н.В., Ланкин В.З., Меньщикова Е.Б., Просенко А.Е.
Фенольные биоантиоксиданты. Новосибирск.: СО РАМН, 2003. 328 с.
14. Ланкин В.З., Тихазе А.К., Коновалова Г.Г. Концентрационная инверсия
антиоксидантного и прооксидантного действия b-каротина в тканях in vivo // Бюлл. эксп. биологии и медицины. 1999. Т.128. № 9. С.314-316.
15. Храпова Н.Г. Система природных антиоксидантов и возможность направленного
воздействия на нее синтетическими ингибиторами. Автореф. дис. . . . д-ра. хим.
наук. М.: Институт биохимической физики им. Н.М. Эмануэля РАН, 1988. 26 с.
16. Кандалинцева Н.В. Синтез, свойства
и исследование антиокислительной активности галогенидов S-[ω-(4-гидроксиарил)алкил]изотиурония.
Автореф. дис. . . . канд. хим. наук. Новосибирск.: Новосибирский
государственный педагогический университет, 2002. 24 с.
17. Бурлакова Е.Б., Крашаков С.А., Храпова Н.Г. Роль токоферолов в пероксидном
окислении липидов биомембран // Биологические мембраны, 1998. Т.15 (2).
С.137-167.
18.
Nagaoka S.,
Okauchi Y., Urano S., Nagashima U., Mukai K. Kinetic and ad initio study of the
prooxidant effect of vitamin E. Hydrogen abstraction from fatty acid esters and
egg yolk lecithin // J. Am. Chem. Soc. 1990. V.112 (24). P.8921-8924.
19.
Mukai K., Okauchi Y. Kinetic study of the
reaction between tocopheroxyl radical and unsaturated fatty acid esters in
benzene // Lipids, 1989. V.24 (11). P. 936-939.
20. Денисов Е.Т. Элементарные реакции
ингибиторов окисления // Успехи химии, 1973. Т.42 (3). С. 361-390.