Медицина/
12. Инфекционные болезни
К.фарм.н.
Гущина Ю.Ш., Олихина И.А.
Российский университет дружбы народов
Анализ причин изменения
схем антретровирусной терапии у ВИЧ-инфицированых пациентов.
Разработка высокоактивной антиретровирусной терапии
(ВААРТ), включающей на настоящий момент времени 7 классов препаратов, позволила
кардинально пересмотреть отношение к ведению
ВИЧ-инфекции и перевести ее в категорию контролируемых хронических
заболеваний [1-3]. Успешное
применение ВААРТ в виде схем, комбинирующих
в себе как правило три
антиретровирусных препарата, сыграло значительную роль в снижении ВИЧ-ассоциированной
смертности, а также повышении качества и увеличении продолжительности жизни ВИЧ-инфицированных [4]. Однако все эти
достижения не уменьшают значимость возможных проблем, связанных с пожизненным
приемом данных лекарственных препаратов, в частности:
формирование вирусной резистентности, возникновение побочных эффектов,
необходимость сочетания ВААРТ с терапией других заболеваний, планирование
беременности пациентами. Наличие таких аспектов приводит к достаточно частой
замене схем терапии, что ухудшает прогноз жизни пациента, а также несет с собой
дополнительные расходы. Цель проведенного исследования заключалась в
определении частоты изменения схем ВААРТ,
оценке средней продолжительности применения различных схем ВААРТ до момента наступления неудачного исхода, а также
выявления наиболее значимых причин, по которым приходилось изменять схемы ВААРТ.
Проведенное
исследование включало в себя ретроспективный анализ 60 отобранных карт пациентов с ВИЧ. Согласно критериям отбора в исследовании участвовали карты
пациентов, которым терапия впервые была назначена в период с 2004 по 2012 год ,
ранее не получавшие ВААРТ и состоящие на диспансерном учете.
Анализ
социально-демографического профиля исследуемой группы выявил примерно равное
количество мужчин (55%) и женщин (45%), по возрасту мужчины и женщины также
были сопоставимы: средний возраст пациентов на момент начала терапии составил
31.1 ±6.8
лет. Большая часть пациентов
имела высшее образование (63%) и была
социально занятой (58.3%) . По наличию вредных привычек и зависимости: курение
отмечалось в 36% случаев, алкоголизм –в 4% случаев, 23% пациентов имели опыт
употребления инъекционных наркотических препаратов. Наиболее
распространенным путем заражения в исследуемой группе является незащищенный
половой контакт (в 61.7% случаев), из которых около 7.5% пришлось на гомосексуальные контакты, далее следует
потребление инъекционных наркотических веществ ( в 20% случаев) . Было выявлено, около 48.3% пациентов
впервые начинали ВААРТ, находясь уже на
3 стадии ВИЧ-инфекции, также часто встречались стадии 2Б
и 4Б (по Российской клинической классификации ВИЧ-инфекции) Медиана уровня
CD4-лимфоцитов на момент начала терапии составила 274 клеток/мкл, что говорит о
позднем начале терапии в исследуемой группе. Средняя продолжительность всей терапии
составила 4.8 лет (1-11 лет).
В
качестве первой линии рассмотренным пациентам наиболее часто назначались
следующие схемы: 2 представителя группы
нуклеозидных ингибиторов обратной транскриптазы (НИОТ) + 1 представитель группы
ненуклеозидных ингибиторов обратной транскриптазы (ННИОТ). Частота назначения такой схемы составила 65.0%, наиболее
назначаемой являлась комбинация таких препаратов из этих групп как зидовудин/ламивудин/ эфавиренз (33.3%), также довольно часто
назначалась комбинация диданозин/фосфазид/
эфавиренз (6.7%) .
Остальной
части пациентов (35.0%) была назначена первая линия антиретровирусной терапии в
форме 2 препаратов из группы НИОТ +
препарат из группы ингибиторов протеазы (ИП)
(в виде зидовудин/ламивудин/лопинавир/ритонавир - в 13.3%случаев, в
виде
зидовудин/ламивудин/реатаз/ритонавир - в 3.3%случаев, другие комбинации использовались реже). Всего
в исследуемой популяции на протяжении
рассмотренного периода было использовано 50 различных схем ВААРТ.
В исследуемой группы пациентов смена терапии проводилась довольно часто. На момент обработки
данных продолжали получать первоначально
назначенную схему ВААРТ
только 21.6% пациентов. Как минимум один раз изменения в схеме терапии
проводили в 78.3% случаев. При этом 2 смены терапии выявлено у 60% пациентов, 3-4
смены - у 30% и 5-6
смен – у 6.4% исследуемой
популяции. Максимальное количество изменений в терапии, зафиксированное за 9
лет наблюдения, составило 11 коррекций
схем антиретровирусной терапии. Средняя продолжительность применения
первой назначенной схемы ВААРТ до момента ее замены составила 12.8 месяцев, при
этом через 1 год после начала терапии
ее смена потребовалась 73.2% пациентов (рис.1). Средняя продолжительность применения второй и третьей схем
составила соответственно 16.5 и 16.9 месяцев.
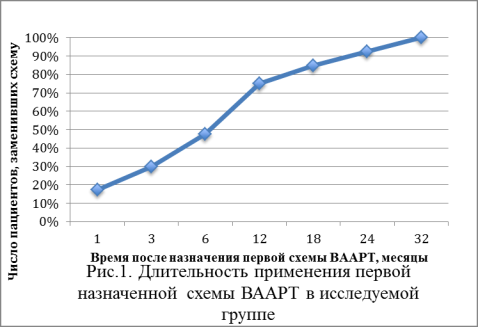
На основе заключений, приведенных врачом-инфекционистом в картах пациентов, был выявлен ряд причин, послуживших
основанием для смены терапии. Наиболее
частой причиной смены терапии независимо от номера смены стало возникновение нежелательных лекарственных
реакций (НЛР)- в 47.8% случаев (рис.2).
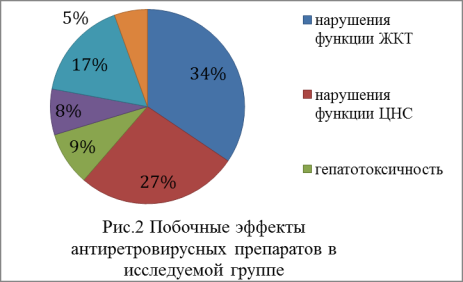
Среди всех зафиксированных острых НЛР наиболее часто причиной смены терапии послужили возникновение
тошноты и рвоты (в 14.0% случаев), реакции гиперчувствительности (12.7%), гепатотоксичность (12.7%), анемия (9.0%) и
другие. Кроме того в 16.3% случаев смены терапии по причине НЛР отмечен риск развития отдаленных побочных
эффектов (липодистрофии,
сердечно-сосудистые осложнения). Часто схему
(в 16.5% случаев) меняли из-за отсутствия в наличии ранее назначенного
препарата, даже если первоначальная
схема была эффективна для пациента. Кроме
того замену первоначальной схемы
терапии проводили по причине планирования беременности пациенткой, а именно в 8.7% случаев (требовалась замена
тератогенного в 1 триместре эфавиренза на более безопасный лопинавир). В связи
с началом терапии сопутствующих заболеваний терапию модифицировали в 7.0%
случаев (чаще всего это касалось терапии хронического гепатита С и замены ). Стоит отметить, что по причине
иммунологической и вирусологической неэффективности, которая как известно может
быть обусловлена резистентностью вируса к препарату, заменять терапию пришлось
в сравнительно небольшом числе случаев
(8.7% ). Среди других причин для смены терапии были зафиксированы: стремление
оптимизировать схему, т.е. замена нескольких препаратов на комбинированный с
целью удобства приема и соответственно увеличения приверженности к лечению (5.2%),
а также случаи назначения новой схемы при возобновления пациентом терапии после
перерыва в лечении (6.1%)
Таким образом в исследуемой
популяции отмечается высокая частота замены схем ВААРТ. При этом необходимость
в смене терапии для половины рассмотренных пациентов наступила уже через
полгода от начала лечения, что является крайне незначительным сроком, учитывая
ограниченный арсенал препаратов ВААРТ. Смена терапии в большом числе случаев
была обусловлена возникновением острых и отдаленных побочных эффектов. Необходимы
дополнительные исследования для понимания важности раннего выявления и более
активной коррекции побочных эффектов, а также исследования экономической
эффективности использования препаратов
с лучшим профилем безопасности для того, чтобы увеличить
продолжительность применения первой линии терапии и таким образом улучшить
прогноз заболевания в будущем. Препараты которые не требуют замены при планировании
беременности и терапии распространенных сопутствующих заболеваний должны чаще
назначаться в качестве первой линии терапии. Следует отметить, часто
модифицировали эффективную у данного пациента схему по причине отсутствия
препарата, что потенциально можно было избежать.
Литература.
1)Dieffenbach CW, Fauci AS. Thirty years of HIV and AIDS: future
challenges and opportunities. Ann Intern Med. 2011 Jun 7;154(11):766-71.
2)Hawkins T. Understanding and managing the adverse effects of
antiretroviral therapy. Antiviral Res. 2010 Jan;85(1):201-9. doi:
10.1016/j.antiviral.2009.10.016. Epub 2009 Oct 24.
3)Mendelsohn JB, Schilperoord M, Spiegel P, Ross DA. Adherence to
antiretroviral therapy and treatment outcomes among conflict-affected and
forcibly displaced populations: a systematic review. Confl
Health. 2012 Oct 31;6(1):9.
4)Smit M, Cremin I, et al Could better tolerated HIV drug regimens
improve patient outcome? AIDS. 2012 Sep 24;26(15):1953-9.