Кістенюк
Т.С.
Національний університет харчових технологій
Перспективи застосування наночасток в медицині.
Наночастинки –
органічні та неорганічні структури, що мають розмір менше cта
нанометрів. нано означає одна мільярдна (10-9) метра (з грецької nanos – карлик, гномик; частинка – окрема одиниця, яка ві- докремлюється від
цілого) [1].
Відомо, що
властивості речовини залежать від розмірів зразка. Однією з головних причин
змінення фізичних та хімічних властивостей малих часточок при зменшенні їх
розмірів є зростання відносної долі «по- верхневих» атомів, що знаходяться в
інших умовах (координаційне число, симетрія локального оточення та ін.), ніж
атоми всередині об‘ємної фази. З енерге- тичної точки зору зменшення розмірів
частинок приз- водить до збільшення ролі поверхневої енергії [2].
При дослідженні
нанорозмірних матеріалів було виявлено значні зміни хімічних, фізичних та
фізико-хімічних параметрів речовини. У нанометровому діапазоні змінюються
електропровідність речовин, термостійкість, магнітні властивості, коефіцієнт
оптичної щільності, вплив на організм людини та ін. [1].
Зміна
фізико-хімічних механізмів дії наночастинок зумовлена тим, що більшість атомів
знаходиться на поверхні. Таке розташування змінює фізичні, хімічні, біологічні,
токсикологічні властивості речовини та сприяє полегшенню взаємодії наночастинок
з живим організмом.
Більшість існуючих
нині нанопрепаратів використовуються для цільової доставки лікарських засобів і
являють собою комплекс відомої фармакологічної речовини і наночастинок. Такі
комплекси використовуються для діагностики з метою більш глибокого проникнення
лікарських засобів до патологічного вогнища, а також зменшення дози препаратів
[3]. Наночастинки, які застосовуються у медицині, розрізняють в залежності від
речовини, типу зв‘язку та форми кластерів, що їх утворюють (рис. 1).
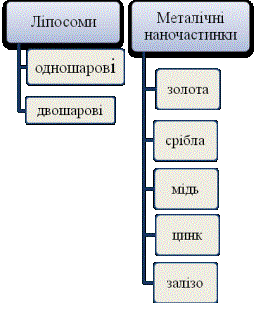
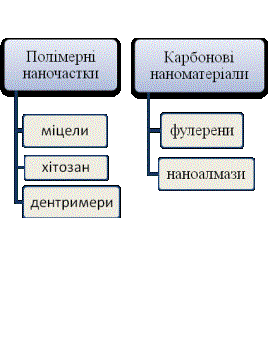
Рис. 1. Види наноматеріалів, що використовуються в медицині.
Ліпосоми складаються
з одно- або двошарової ліпідної оболонки, яку отримують із природних неток-
сичних фосфоліпідів і холестерину та рідкого фармацевтичного інгредієнту або
лікарської речовини. Оптимальний розмір ліпосом від 100 нм до 500 нм [4]. Серед
їх переваг можна відзначити високу механічну стійкість ліпідної оболонки,
здатність переносити лікарські речовини до уражених органів, високу біоспо-
рідненість та здатність до біодеградації. Недоліком ліпосом для застосування у
медицині є їхня нестійкість та нетривале перебування у кров‘яному руслі
внаслідок захоплення макрофагами і виведення із організму [5, 6].
Для запобігання
фагоцитозу ліпосоми вкривають поліетиленгліколем, що значно збільшує термін
перебування їх в організмі. На поверхню ліпосоми можуть бути нанесені ліганди
для клітин-мішеней, що дозволяє їй прикріплюватися та накопичуватися у середо-
вищі патологічного процесу [7].
Полімерні
наночастинки – найбільш широкий та досліджений клас наноматеріалів, до складу
якого входять природні біополімери і синтетичні наночастинки. Полімерні міцели – сферичні колоїдні
частинки з гідрофобним ядром та гідрофільною оболонкою. Фармакологічна речовина
може знаходитися як в середині ядра так
і приєднуватись до поверхні міцели. Як і ліпосоми, міцели можуть нести
на своїй поверхні ліганди (наприклад, до клітин пухлини). Переваги інкапсуляції
активних речовин в полімерну матрицю забезпечують їм захист від навколишнього
середовища або умов обробки та їх контрольоване вивільнення [8].
В останні роки все
більший інтерес представляє використання хітозану для інкапсуляції активних
компонентів, що зумовлене його біосумісністю, відсутністю токсичності та
здатності до біологічного розпаду [8]. Групою вчених розроблено нові
наносистеми переносу мРНК, що складаються із біосумісних полімерів
глікольхітозана (GC) та позитивно заряджених полімерів поліетиленіміна (PEI).
Дендримери - це
новий клас полімерних наноматеріалів. Вони представляють собою макромолекули,
що мають широко розгалужену 3D структуру, яка забезпечує високий стyпінь
функціональності поверхні та універсальність [9]. Дендритні молекули мають
багато розгалужень (міцели), що дозволяє включення до них наночастинок та
частинок металів. Існує велика кількість цих фрактальних конструкцій,
розчинність яких залежить від модифікації поверхні. Відомо більш ніж 160
різноманітних полімерів, що мають дендритну структуру. Високорозчинні
нейтральні дендримери застосовуються як засоби візуалізації при проведенні МРТ,
доставки радіоактивних ізотопів та ліків [9].
Фулерени визначають
як замкнені сферичні багатогранники, цілком побудовані з тричі координованих
атомів вуглецю, що мають 12 пентагональних та n гексагональних граней, де
n>20. В назві фулеренів враховується число атомів вуглецю в молекулі, при
цьому найбільш стабільним є фулерени, що відповідають правилу ізольованих
пентагонів. Фулерени та їх похідні мають біологічну актив- ність, проявляючи
анти- або прооксидантні властивості в залежності від субстрату та умов
оточуючого середовища [10], і вважаються перспективними в якості потенційних
носіїв ліків та радіоактивних міток [11, 12].
Нанодіаманти (НД)
складаються з флуоресцентних вуглецевих наночастинок. Спочатку вони були
розроблені для обробки промислових об‘єктів, але потім завдяки фотостабільності та відсутності
флуоресцентного відсвічування стало можливим спостерігання НД у живих клітинах.
Вченими проведено ряд досліджень з кон‘югації НД із білками (декстрин, бичачий
сироватковий альбумін) та цукрами. У цій роботі була доказана стабільність та
нетоксичність цих наночастинок та можливість використання їх для доставки малих
доз препаратів до тканин. Модифіковані НД активно зв‘язують різні лікарські
препарати, здатні про- никати до клітин-мішеней, таких як мікроорганізми,
клітини імунної системи або ракові клітини, та передавати лікарський препарат
безпосередньо у клітину. Завдяки високій сорбційній здатності нанодіаманти
можуть використовуватися в медицині як ентеросорбенти для виведення небажаних
та токсичних сполук [12].
Список літератури:
1.
Микитюк. М.В. Наночастинки та
перспективи їх застосуваня в біології і медицині // Проблеми екології та
медицини. – 2011. – Том 15 № 5-6, 2011. – С. 42 -47.
2.
Губин
С.П., Кокшаров Ю.А, Хомутов Г.Б. и др.
Магнитные наночастицы: методы получения, строение и свойства // Успехи химии. –
2005. – №74(6). – С. 539–574.
3.
Чекман
І.С. Фармакологічні та фармацевтичні основи нанопрепаратів //
Лікарська справа. – 2010. – №.1-2. – С. 3-9.
4.
Дудниченко
А. С., Краснопольский Ю. М., Швец В. И.
Липосомальные лекарственные препараты в эксперименте и клинике. – Х.:
Каравелла. — 2001. – 143 с
5.
Барсуков
Л.И. Липосомы // Соросовский образовательный журнал. – 1998. –
№10. – С. 2-9.
6.
Глущенко
Н.Н., Скальный А.В. Токсичность наночастиц цинка и его
биологические свойства // Актуальне проблемы тарнспортной медицины. – 2010. –
№3(21). – С118-120.
7.
Пасечников
Н.В., Мальцев Э.В., Мороз О.А. Нанотехнологии,
наномедицина, наноофтальмология // Офтальмологический журнал. – 2009. – № 6. –
С. 83- 89.
8.
Harrisa
R., Lecumberria E., Mateos-Aparicioa I. et al.
Chitosan nanoparticles and macrospheres for the encapsulation of natural
antioxidants extracted from Ilex paraguariensis // Corbogydrat Polymers. –
2011. – Vol. 84. – P. 803-806.
9.
Nanjwadea B.K., Bechraa H.M. et al. Dendrimers: Emergin
polymers for drug-delivery systems // Colloids and Surfaces B: Bioiterfaces. –
2011. – Vol. 83. – P. 360-366.
10.
Дудниченко А.
С., Краснопольский Ю. М., Швец В. И. Липосомальные лекарственные препараты в
эксперименте и клинике. – Х.: Каравелла. ˗ 2001. – 143 с.
11.
Чекман І.С., Горчакова Н.О., Озейчук О.Ю. Наноматеріали і
наночастинки: класифікація // Науковий вісник національного медичного
університету ім. О.О. Богомольця. – 2009. – № 2. – С. 188-201.
12.
Bosi S., Da Ros T., Spalluto G. et al. Fullerene
derivatives: an attractive tool forbiological applications // Eur. J. Med Chem.
– 2003. – Vol. 286. – P.344-353.