УДК 669.536.221
А.В.
Баталов, К.т.н. А.Г. Уполовникова
Институт металлургии УрО РАН, г. Екатеринбург,
Россия, upol.ru@mail.ru
КИНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ СОЛЯНОКИСЛОГО ВЫЩЕЛАЧИВАНИЯ ЦИНКОВЫХ КЕКОВ
При производстве цинка
гидрометаллургическим способом остаются кеки, содержащие Zn, Fe, Ag и Au. В настоящее время цинковые кеки
перерабатываются следующими способами: вельц-процесс, обжиг кеков в смеси с
цинковыми или пиритными концентратами и методом выщелачивания кеков в серной
кислоте при повышенной температуре [1]. Основным недостатком этих способов переработки цинковых кеков является безвозвратная
потеря благородных металлов, таких как золото и серебро. В связи с этим
актуальна проблема комплексной переработки цинковых кеков. Рассмотрена возможность использования
гидрометаллургической схемы переработки цинковых кеков, сущность которой
заключается в извлечении кислотами цинка, железа и других компонентов в раствор
и концентрировании благородных металлов в твердом остатке. По предлагаемой
технологии после очистки от примесей растворы подвергаются
разложению - пирогидролизу, в результате которого регенерируется соляная
кислота и образуется товарный продукт - оксид цинка.
В представленной работе
проведено экспериментальное исследование солянокислого выщелачивания цинковых
кеков ОАО «Электроцинк» (г. Владикавказ), содержащих, масс.%: 22.0 Zn, 27.3 Fe, 3.1 Mn, 1.7 Cu, 1.3 Pb, 0.12 Cd, 0.01 Co,
5.0 SiO2, 1.3 CaO,
0.7 MgO, а также (в г/т) 469 Ag и
3 Au. По результатам
рентгенофазового анализа основными компонентами цинкового кека являются ZnFe2O4 и β-ZnS -
феррит и сульфид цинка. Реакции
процесса:
1) ZnFe2O4 + 2HCl
= ZnCl2 + Fe2O3 + H2O
2) ZnFe2O4 + 8HCl = ZnCl2 + 2FeCl3 + 4H2O
Для кинетического анализа использована
методика исследования процессов выщелачивания [2], основанная на представлениях
диффузионной макрокинетики и принципах моделирования процессов выщелачивания в
реакторах периодического действия.
Для определения энергии активации
проведены два опыта при различных температурах Т1=353K и Т2=323K (концентрация 20% HCl, Ж:Т=10). Полученные зависимости извлечения
компонентов в раствор от продолжительности выщелачивания представлены на
рисунке 1.
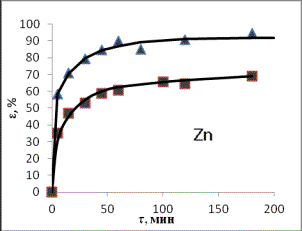
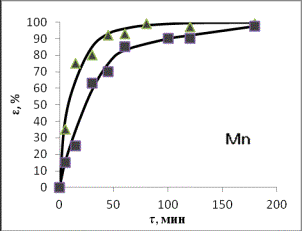
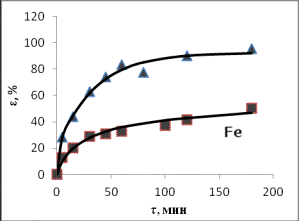
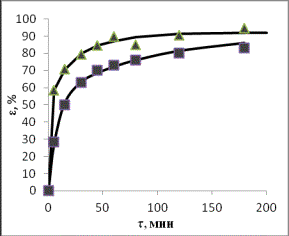
Рис. 1. Зависимости степени извлечения элементов в
раствор от продолжительности выщелачивания при
температурах ▲ – 80оС;
■– 50оС (СHCl =
20%)
По кинетическим кривым определены значения
τ1 и τ2
– времени достижения равных извлечений в первом и втором опытах, и построены графики зависимости τ1 от
τ2, по которым через угловые коэффициенты рассчитаны энергии
активации:
![]() (1),
(1),
где а – угловой
коэффициент.
Энергия активации для
рассмотренных элементов составила, кДж/моль: 68,7 для цинка, 68,1 для железа,
25,3 для марганца, из чего следует, что растворение соединений цинка и железа
лимитируется скоростью химической реакцией, а марганца - диффузионными
процессами (табл.1).
Для определения порядка реакции проведены
два опыта в одинаковых условиях, но при различных концентрациях соляной кислоты
С1=20% и С2=10%. Получены зависимости степеней извлечения
компонентов в раствор от продолжительности выщелачивания, представленные на
рисунке 2.
По кинетическим кривым
определены значения τ1 и τ2 – времени
достижения равных извлечений при С1
и С2, по которым рассчитан порядок реакции n .
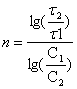 (2).
(2).
Формальный
порядок реакции процесса растворения для цинка равен 1,8, для железа – 2,0, для
марганца – 1,2 и для серы – 0,5
(табл.1).
Таблица
1 - Кинетические параметры извлечения элементов в раствор
|
Параметр |
Zn |
Fe |
Mn |
|
Кажущаяся энергия активации
- E , кДж/моль |
68,6 |
68,1 |
25,3 |
|
Формальный порядок реакции
- n,
ед. |
1,8 |
2,0 |
1,2 |
Fe Zn
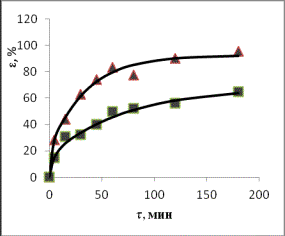
Mn
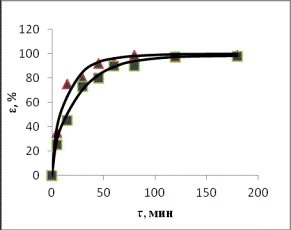
▲– 20% HCl;
■– 10% HCl
Рис. 2. Зависимости степени извлечения элементов от
продолжительности выщелачивания при различных концентрациях соляной кислоты
(Т=80оС)
Знание величин энергии
активации E*, порядка реакции n и времени предельного выщелачивания τo при
некоторых фиксированных температуре и концентрации позволяет оценить
продолжительность процесса максимального перевода в раствор определяемого
элемента τi при любых значениях T и C по следующим уравнениям -
кинетическим моделям солянокислого
выщелачивания цинковых кеков:
![]() , (3)
, (3)
![]() , (4)
, (4)
![]() , (5)
, (5)
Согласно данным кинетическим
уравнениям, для предельного извлечения в раствор цинка 20% р-ром HCl при 363K потребуется около 80 мин, железа и
марганца – 95 мин, то есть теоретически для выщелачивания цинковых кеков в
указанных условиях необходимо не менее
95 минут. В результате проведенных исследований можно рекомендовать в
качестве оптимальных условий выщелачивания цинкового кека следующие режимные
параметры: температура T = 363K, CHCl = 20%, Ж:Т = 4, продолжительность
выщелачивания 95 минут. Следует отметить, что по данным РФА кеки выщелачивания,
полученные в указанных условиях, содержат остаточные количества β-ZnS, что хорошо согласуется с результатами
термодинамического моделирования.[3]
Твердый остаток выщелачивания
содержит, масс.%: 15,5 Zn, 13,3 Fe,
0,04 Mn, 6,4 S, 0,26 Ag, 0,004 Au.
Таким
образом, в результате выполненных исследований установлено, что разложение ZnFe2O4 с переходом в раствор железа и цинка
лимитируется скоростью химического взаимодействия, а извлечение марганца
протекает в диффузионной области. Полученные кинетические закономерности
кислотного разложения цинковых кеков соляной кислотой могут быть использованы
для оптимизации режимных параметров процесса.
Работа выполнена
при поддержке УрО РАН по программе ОХНМ (проект №12-Т-3-1023)
и Инновационному проекту
молодых ученых (№ 14-3-ИП-55).
Литература
1.
Л.А. Казанбаев, П.А.
Козлов, В.Л. Кубасов, А.В. Колесников Гидрометаллургия цинка (очистка растворов
и электролиз). – М.: Издательский дом «Руда и металлы», 2006. – 176с.
2.
Е.М.Вигдорчик,
А.Б.Шейнин Математическое моделирование непрерывных процессов растворения Л.:
Химия, 1971. -248с.
3.
Л.Ю. Удоева, В.М.
Чумарев, А.Г. Уполовникова Исследование процесса гидрохимической переработки
цинковых кеков. // Приволжский научный вестник, №6(22), 2013, с.42-46.