РАЦИОНАЛЬНЫЕ ОСНОВЫ ЭНЕРГОТРОПНОЙ ТЕРАПИИ
Н.В. Рылова,
А.А. Биктимирова, А.С. Самойлов
ГБОУ ДПО «Казанская
государственная медицинская академия Минздрава РФ»
ФГБУЗ «Центр лечебной
физкультуры и спортивной медицины» Федерального медико-биологического
агентства, Москва
Энерготропная
терапия – это комплекс лечебно-профилактических мероприятий, призванных решить
проблемы нарушения внутриклеточных процессов энергообмена. В
современных условиях активного роста популярности детско-юношеского спорта,
спорта высших достижений становится очень актуальным вопрос повышения
работоспособности и скорейшего восстановления организма после нагрузки [1]. Важнейшим
механизмом, определяющим работоспособность и восстановление,
является продуцирование энергии.
При
физической нагрузке необходимо более интенсивное обеспечение мышечной
деятельности АТФ, что способствует истощению ресурсов и развитию
энергодефицитного состояния. Проявляться данное состояние может общим упадком сил, дисфункциями отдельных органов или
систем, переутомлением, нервно-психическим стрессом. Хотя организм человека
может нормально функционировать, в частности, спортсмен может демонстрировать
неплохие результаты, однако в дальнейшем это приводит к
развитию негативных последствий на психофизиологическом или соматическом уровне
и к ухудшению спортивных показателей [2, 3]. Становится очевидным, что
состояние энергодефицита требует коррекции. Своевременная диагностика причин,
ограничивающих физическую деятельность, возможность повлиять на эти факторы и
правильное применение методов коррекции помогают достичь высоких результатов в
спорте и, в первую очередь, сохранить здоровье спортсмена. Однако необходимо помнить,
что при использовании различных методов, воздействующих на механизмы адаптации
к физической нагрузке, энергообеспечение, важно учитывать индивидуальные
особенности организма каждого спортсмена, возраст, пол, его спортивные
достижения и квалификацию [4, 5].
Процессы энергообмена
и основные метаболические изменения осуществляются за счет универсальных
органелл — митохондрий [6]. В последние годы теория
ремоделлирования стала вытеснять представления о митохондриях, как о статичных
субстанциях. Так, при определенных условиях митохондрии способны образовывать
конгломераты или претерпевать процесс деления, сохраняя при этом общую
наружную мембрану [7, 8]. Особое
значение в последние годы приобретает понятие митохондриальная патология. Согласно литературным данным выделяют морфологические,
биохимические критерии и клинические симптомы митохондриальной недостаточности:
цитохимические признаки угнетения активности ферментов СДГ, α-ГФДГ, ЛДГ,
снижение уровня карнитина в крови, низкая толерантность к физическим нагрузкам,
быстрая утомляемость [7,9].
00Несмотря
на то, что окислительная способность мышц определяется количеством митохондрий
и активностью окислительных ферментов в них, клеточный метаболизм, в конечном
счете, зависит от адекватности снабжения кислородом. В
результате дефицита кислорода в клетках происходит накопление промежуточных
продуктов обмена свободных жирных кислот – ацилкарнитина, ацил–КоА, НАД•Н,
угнетается пируватдегидрогеназа, соответственно, возможность утилизации
пирувата устраняется, в результате чего он практически полностью превращается в
лактат. Лактат накапливается в цитозоле вместе с Н+, что приводит к снижению
внутриклеточного рН и нарушению функции клетки. Помимо этого, промежуточные
продукты обмена свободных жирных кислот затрудняют перенос макроэргических
фосфатов через их мембрану, содействуя снижению энергодефицита и дальнейшей
активации гликолиза. Выраженность этих процессов увеличивается по мере
возрастания тяжести гипоксии. Это способствует возникновению тяжелого ацидоза,
что сначала приводит к функциональным нарушениям, повреждению мембран, а в
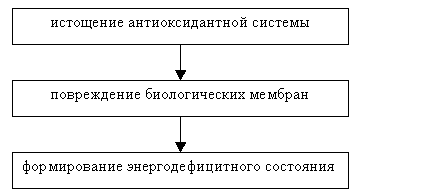
итоге и к гибели клетки [10]. Повреждение клеточных структур можно
охарактеризовать последовательностью, представленную на схеме (рис. 1) [4].
Рис.
1. Последовательность повреждения клеточных структур.
Повышение работоспособности, с
медицинской точки зрения, состоит в разработке и применении таких средств,
которые должны воздействовать на биохимические и функциональные резервы
организма и отдалять наступление утомления [4].
Фармакологические препараты, применяемые в спорте, прежде всего, ориентированы
на здорового человека и не выходят за рамки запрещенного списка, составленного
Всемирным антидопинговым агентством. Они повышают физическую работоспособность,
психическую устойчивость и способность к быстрому восстановлению ресурсов
организма [11]. По официальным данным, на сегодняшний день уже 48% юных
спортсменов используют те или иные разрешенные или запрещенные «эргогенные»
субстанции для достижения наилучших результатов [12]. При использовании
фармакологических средств коррекции обращают внимание на потребности органов и
систем в соответствии с этапами подготовки спортсмена, возможность скорейшего
приобретения качеств, присущих виду спорта (скорость, сила, выносливость,
координация), необходимость получения эффекта суперкомпенсации для достижения
максимального соревновательного результата [2].
Одной из основных задач, стоящих перед спортивной медициной, является
поддержание здоровья, предупреждение негативного влияния интенсивных физических
нагрузок на организм спортсменов, ведущих к травмам и раннему окончанию карьеры
[13].
Применение
средств энерготропной терапии при различных патологических состояниях
(поражение сердечно-сосудистой, дыхательной систем), инфекционных заболеваниях
изучено достаточно подробно.
Приоритетной задачей медицины на сегодняшний день
является развитие профилактического направления, вопросы
оздоровления, формирования здорового образа жизни, привлечение детей и
подростков к активным, регулярным занятиям физической культурой и спортом. В связи с этим многими авторами
предпринимаются попытки изучить возможность применения средств метаболической
коррекции для повышения адаптационных процессов у юных спортсменов [13].
Энерготропными
препаратами называются метаболически активные
средства, мишенью которых являются механизмы энергетического обмена. Они
оказывают воздействие на внутриклеточные процессы анаэробного и аэробного
окисления [14]. К таким веществам относятся L-карнитин, коэнзим Q10,
тиамин, янтарная кислота, никотинамид, рибофлавин, малат, цитруллин [15]. В
зависимости от этапов клеточного метаболизма, на которые должно воздействовать
вещество, выделяют несколько групп препаратов (табл. 1). Однако данное
разделение является условным, так как представленные средства могут выполнять
различные функции в метаболизме клетки [12].
Таблица 1
Средства,
применяемые при нарушениях клеточного энергообмена [14].
|
Переносящие электроны |
Витамины К1 и К3, коэнзим Q10, янтарная
кислота, цитохром С, биофлавоноиды |
|
Кофакторы энергообмена |
Витамины группы В, РР, липоевая кислота,
биотин, L-карнитин |
|
Уменьшающие степень лактат-ацидоза |
Димефосфон |
|
Антиоксиданты |
Витамины С и Е |
В практике
наиболее целесообразным считается применение комплексов энерготропных
препаратов, которые обладают способностью воздействовать на несколько звеньев
клеточного энергообмена. Это объясняется тем, что не всегда удается выявить
точечное повреждение митохондрий, так как в большинстве случаев клинически
проявляются симптомы митохондриальной дисфункции, а на каком именно этапе
произошел сбой, сказать сложно. Наличие же эффективного
диагностического инструментария, разработка клинических, биохимических,
морфологических и молекулярно-генетических критериев митохондриальной
недостаточности, позволяет оценивать полисистемность нарушения клеточного
энергообмена и воздействовать на него [14].
Особое внимание среди метаболических препаратов
уделяется препаратам L-карнитина. Карнитин – это вещество, которое необходимо
для ведения метаболических процессов в клетке и поддержания сохранности тканей.
Большинство клеток организма обладают способностью синтезировать эндогенный
карнитин в течение всей жизни. Карнитин поступает с пищей или синтезируется из
незаменимых аминокислот лизина и метионина [16]. В
стрессовой для клетки ситуации может возникать дефицит карнитина, что в первую
очередь отражается на внутриклеточном его содержании (концентрация карнитина в
плазме менее 20 мкмоль/л, а в тканях менее 20% от нормы). В условиях гипоксии
также изменяется метаболизм жирных кислот, который характеризуется нарушением
β-окисления жирных кислот. Этот процесс сопряжен со снижением уровня
карнитина, в результате чего происходит внутриклеточное накопление жирных
кислот, ацилкарнитинов, ацил-КоА. Повышенная концентрация ацил-КоА подавляет
транспорт адениннуклеотидов в митохондриях, уменьшает активность
ацил-КоА-синтетазы [17, 18]. При дефиците ферментов, осуществляющих транспорт
карнитина и его соединений через митохондриальные мембраны, возникает нарушение
транспорта карнитина. Дефицит транспортных ферментов нарушает перенос
длинноцепочечных жирных кислот в комплексе с карнитином через митохондриальные
мембраны, возникает дефицит ацетил-КоА, что уменьшает активность цикла Кребса
[19].
В зависимости от причины дефицита карнитина выделяют первичный дефицит
карнитина, обусловленный дефектом транспорта
карнитина в клетки и ткани, который возникает при генетически
детерминированных дефектах метаболизма карнитина, и имеет аутосомно-рецессивный тип наследования. Данный вид
дефицита является достаточно редкой патологией. Вторичная недостаточность
карнитина характерна для группы наследственных заболеваний обмена веществ, в
том числе для болезней транспорта и окисления жирных кислот, органических ацидемий,
когда наблюдается преобладание потерь карнитина над его поступлением. При этих
состояниях происходит активное выведение конъюгатов карнитина с токсичными
органическими кислотами через мочу, что и обуславливает низкий уровень
карнитина в крови и тканях. Вторичный дефицит карнитина, связан с
нарушением обмена органических кислот, дефицитом ацил-КоА-дегидрогеназ,
дефектами в цепи дыхательных ферментов митохондрий и некоторыми соматическими
заболеваниями и патологическими состояниями [17, 20]. Вторичная карнитиновая недостаточность
может быстро формироваться у подростков, так как запасы этого метаболита в
организме ограничены [3]. Симптомы недостаточности карнитина разнообразны и
неспецифичны и обусловлены нарушением работы трех основных систем: сердечной
мышцы; центральной нервной системы и скелетных мышц [21].
Карнитин
встречается в виде двух форм: L и D изомеров, в организме
человека синтезируется только L-карнитин, а D-карнитин биологически
не активен [22]. Впервые L-карнитин был выделен В.С. Гулевичем и Р.З.
Кримбергом более ста лет назад - в 1905 году из экстракта мышечной ткани [15]. Структура карнитина была установлена в 1927 году,
а его функции были изучены всего пятьдесят лет назад. Оказалось, что витаминоподобная
аминокислота, которая способна синтезироваться в организме, является
стимулятором окисления жирных кислот в энергетическом центре животной клетки
[21]. L-карнитин – это вещество из группы четвертичных аминов, которое
играет важную роль в энергетическом обмене клетки за счет переноса
длинноцепочечных жирных кислот в форме ацилкарнитина из цитозоли внутрь
митохондрии с целью дальнейшего β-окисления и образования АТФ, таким
образом, увеличивается поступление наиболее предпочтительных субстратов для
окислительного метаболизма. А в условиях гипоксии данное
вещество предотвращает накопление эфиров жирных кислот. Кроме
того, карнитин участвует в окислении среднецепочечных жирных кислот в цитозоле;
поддерживает необходимый для нормального течения метаболических процессов
клетки пул свободного коэнзима А (СоА), предотвращая накопление соединений
данного вещества, так как они могут ингибировать активность многих ферментов и
вызывать нарушение метаболизма жирных кислот. При помощи карнитина сохраняется
целостность мембран, подавляется образование лактата и, частично, процессы
апоптоза [13, 23]. В условиях гипоксии тканей содержание L–карнитина снижается [14, 24].
Эндогенный
синтез L-карнитина происходит в печени путем трансформации лизина, донатором
метильных групп при этом является метионин. Источником лизина и метионина
являются пищевые продукты, а также собственные белки мышечной ткани. В синтезе
L-карнитина принимают участие витамины С, В3, В6, фолиевая кислота, железо и
некоторые ферменты [21, 25]. 97 % L-карнитина находится в скелетных мышцах и
миокарде. Это ткани, которые используют жирные кислоты, в качестве главного
источника энергии [26]. Поэтому при организации питания спортсменов необходимо
учитывать белковую, энергетическую ценность продуктов, содержание жиров в
рационе. Питание юных спортсменов с низким
содержанием жиров подавляет запас триглицеридов, что клинически выражается в
раннем наступлении утомления в процессе тренировок [27].
Необходимо помнить, что потребность
в L-карнитине зависит от возраста, вида спорта и повышается при физических и
психо-эмоциональных нагрузках в несколько раз. Ежедневный пищевой рацион,
включающий в себя полноценное разнообразное питание, то есть продукты, как
животного, так и растительного происхождения, обеспечивает 25% потребности
организма в L-карнитине. Поэтому становится необходимым прием препаратов L-карнитина для восстановления его уровня при интенсивных
нагрузках [28, 29]. При применении препаратов
L-карнитина у юных спортсменов увеличивается длительность и интенсивность
тренировок, повышается физическая выносливость, занятия становятся более
эффективными [30, 31]. Положительный эффект от применения карнитина у спортсменов
во время интенсивной физической нагрузки описан более чем в 300 зарубежных и
отечественных исследованиях. В этих работах изучались разные по длительности и
дозированию схемы применения препарата. Некоторые данные, полученные в
независимых зарубежных исследованиях, приведены в таблице 2 [29, 32, 33-40].
Таблица 2.
Результаты применения L-карнитина у
спортсменов.
|
Доза и длительность
применения L-карнитина |
Полученные результаты |
Количество пациентов (n) |
|
1 г перед тренировкой |
Увеличение
работоспособности |
17 |
|
2 г перед тренировкой |
Увеличение
максимального потребления кислорода |
10 |
|
2
г/сут. в течение 4 недель |
Усиление
активности дыхательной цепи в мышцах |
14 |
|
4
г/сут. в течение 2 недель |
Увеличение максимального потребления кислорода |
6 |
|
3
г/сут. в течение 10 дней |
Усиление
активности дыхательной цепи в мышцах |
10 |
|
1
г/сут. в течение 3 недель |
Увеличение
работоспособности |
110 |
|
1
г/сут. в течение 6 недель |
Увеличение
работоспособности |
24 |
|
2
г/сут. в течение 3 недель |
Увеличение
работоспособности |
10 |
Следует принимать во внимание особенности применения данного
препарата и полученные эффекты: дозировка, длительность приема, этап
подготовки, индивидуальные особенности спортсменов, а также достигаемый
результат. Сочетанное применение L-карнитина с препаратами коэнзима Q10
приводит к активации митохондриального фермента сукцинатдегидрогеназы, то есть
аэробного компонента. В результате комплексного воздействия энерготропных
препаратов снижается потребность в дополнительном компоненте образования
энергии – анаэробном [13]. При длительной нагрузке в аэробных условиях высвобождаются
свободные радикалы, которые негативно влияют на митохондрии, угнетая их
деятельность, что сказывается на энегообеспечении всего организма. Коэнзим Q10
является природным антиоксидантом, действующим особенно активно в сочетании с
витамином Е, и обладает энерготропным, стрессопротекторным и кардиопротекторным
свойствами [41, 42]. От других антиоксидантов Коэнзим Q10 отличает его способность
восстанавливать свою антиоксидантную активность после окисления [43].
Коэнзим Q10 (убихинон) активно синтезируется печенью, а также поступает
в организм с некоторыми продуктами питания (мясо, орехи, яйца). Нормальное содержание убихинона в крови - 1,0 мкг/мл.
В клетках 40-50% коэнзима Q10 содержится в
митохондриях. В дополнительной дозе коэнзима
Q10 нуждаются спортсмены, так как при занятиях спортом его количество в клетках
значительно уменьшается, что может стать причиной истощения организма и
возникновения сердечно-сосудистых заболеваний. Применения коэнзима Q10 при
интенсивной физической нагрузке приводит к снижению субъективного чувства
усталости, позволяя тем самым увеличивать работоспособность и продолжительность
занятий [44].
Применение янтарной кислоты у юных спортсменов
также считается целесообразным. Янтарная кислота является промежуточным
продуктом цикла Кребса и участвует в различных биологических процессах в
клетке. Данное вещество обеспечивает мощную поставку электронов и протонов в
митохондрии, за счет чего реализуется антиоксидантный механизм действия на
уровне организма в целом [12]. В дополнение к ферментативной активности, она
соединяется с белком, для ускоренного восстановления мышечных волокон и нервных
окончаний. У лиц с синдромом хронической усталости выявлено снижение количества
янтарной кислоты в моче. Янтарная кислота синтезируется из нескольких
аминокислот и участвует в анаэробном и аэробном пути образования энергии. По
данным многих авторов, аминокислоты, из которых синтезируется янтарная кислота,
имеют важное значение в обеспечении тканей энергией в условиях гипоксии.
Например, ГАМК аминокислота может либо окисляться до янтарной кислоты для
производства клеточной энергии, либо преобразовываться в ГОМК, в зависимости от
метаболических потребностей организма [45].
Таким образом, для обеспечения
максимальной работоспособности, ускорения механизмов адаптации спортсменов
необходимо учитывать многие факторы. Среди них и адекватный тренировочный
процесс, и полноценный рацион питания, а также возможность фармакологической
поддержки системы энергообеспечения. Применение энерготропных препаратов в
спорте, в первую очередь, направлено на поддержание здоровья, профилактику
негативного влияния интенсивных физических нагрузок на организм. Они повышают физическую работоспособность, психическую
устойчивость и способность к быстрому восстановлению ресурсов организма.
Библиографический список.
1. Сейфулла
Р.Д. Новые
комбинированные адаптогены, повышающие работоспособность спортсменов высокой
квалификации //Теория и практика физической культуры, 1998; №10, С. 47-50.
2. Бундзен П.В., Коротков К.Г., Короткова
А.К., и др. Психофизиологические корреляты успешности соревновательной деятельности спортсменов олимпийского резерва
//Физиология
человека. 2005. – том 31. – № 3. – С. 84-92.
3. Ключников
С.О., Ильяшенко Д.А., Ключников М.С. Эффективность Карнитона и Кудесана у
подростков. Клинико-функциональное и психологическое исследование // Практика
педиатра, 2009. №2. С.23-27.
4. Кулиненков О. С.
Фармакологическая помощь спортсмену: коррекция факторов, лимитирующих
спортивный результат: Советский спорт; Москва; 2007, 145 С.
5. Спортивная медицина:
учебное пособие //под ред. В.А. Епифанова – М.: ГЭОТАР-Медиа, 2006. – 336 С.
6.
Luft R. The development of mitochondrial Medicine
//Proc. Natl. Acad. USA. 1994; 91: рр. 8731—8738.
7.
Richard H.
Haas Mitochondrial Disease: A Practical
Approach for Primary Care Physicians //Pediatrics. 2007; 6: рр 1326-1333.
8. Рылова Н.В., Биктимирова
А.А. Особенности энергообмена у юных спортсменов //Практическая медицина -
Педиатрия №6 (75) 2013, С.30-34.
9. Думова С.В.,
Чугунова О.Л. Внутриклеточные энергетические нарушения у недоношенных детей с
задержкой внутриутробного развития и их коррекция //Практика педиатра, февраль,
2013 С. 68-72.
10. Житникова Л.М.
Триметазидин в метаболической терапии сердечно-сосудистых заболеваний //Русский
медицинский журнал №14, 2012, С. 718-723.
11. Спортивная медицина:
национальное руководство //под редакцией акад. РАМН С.П. Миронова, проф. Б.А.
Поляева, проф. Г.А. Макаровой. – М.: ГЭОТАР, 2012. – 1184 С.
12. Ходарев
С.В., Тертышная Е.С., Поляков С.Д. Интервальная гипоксическая тренировка в
сочетании с триовитом и l-карнитином у юных спортсменов //Лечебная физкультура
и спортивная медицина, 2010, №8(80), С.20-25.
13. Балыкова Л.А., Ивянский
С. А., Урзяева Н. И., и др. Опыт применения метаболических кардиопротекторов в
детской спортивной медицине //Российский кардиологический журнал № 5 (91) /
2011, С. 52-58.
14. Сухоруков В.С. Очерки
митохондриальной патологии. – М.: ИД «МЕДПРАКТИКА-М», 2011. 288 С.
15. Геппе Н.А., Эрдес С.И., Петухова Е.В., и др. Эффективность
L-карнитина в реабилитации детей после перенесенных острых респираторных
заболеваний //Вопросы практической педиатрии, 2010, т. 5, №2, С.50-56
16. Камчатнов, П. Р. Применение карнитина (Элькар) и его производного ацетилкарнитина
(Карницетин) в клинической практике : метод.пособие //П. Р. Камчатнов; Рос.
мед. ун-т. - М., 2010. - 20 С.
17. Luster H. Carnitine and cardiovascular diseases
//PontePressVerlagsGmbH, 2003: р.336.
18. Леонтьева И.В.,
Белозеров Ю.М. Диагностика и лечение метаболических кардиомиопатий, возникающих
при нарушениях обмена жирных кислот, у детей //Лечащий врач, 2012, №9, С.
57-62.
19. Николаева Е.А., Семячкина А.Н., Воздвиженская
Е.С., и др. Коррекция недостаточности карнитина у детей с наследственными
заболеваниями обмена веществ //Педиатрическая
фармакология, 2003 №1(4), С.24-27.
20. Леонтьева И.В.,
Николаева Е.А., Алимина Е.Г., и др. Клиническое значение оценки показателей
карнитинового обмена при кардиомиопатиях у детей //Практика педиатра, октябрь
2012, С. 74-79.
21. Губергриц
Н.Б., Голубова О.А., Лукашевич Г.М. L-карнитин: от биохимических свойств к
клиническому применению //ЛікарськіЗасоби, 2012 № 2 (64), С. 114-121.
22. Спасов А. А., Иежица И. Н.
Стереофармакологические особенности карнитина //Русский
физиологический журнал им. И.М.Сеченова, № 12, 2005, С. 42-47.
23. Siliprandi N., Di Lisa F., Menabo R. Clinical use of carnitine. Past,
present and future //Adv Exp Med Biol 1990; 272: 175.
24. Диниколантонио
Дж.Дж., Лави К.Дж., Фарес Х., и др. L-карнитин для вторичной профилактики сердечно-сосудистых
заболеваний: систематический обзор литературы и метаанализ //РМЖ: Кардиология, эндокринология, 2013, №12, С.
651-656.
25. Копелевич В.М. Чудо
Карнитина. М.: Генезис, 2003; 80 с.
26. Яковлева
Л.В., Безчаснюк Е.М., Улесов А.В. и др. L-карнитин: свойства, препараты, медицинское
применение / //Укр. журн. клін. та лаб. мед.,2011.— Т. 6, № 2, С. 17—24.
27. Рылова Н.В., Хафизова
Г.Н. Актуальные проблемы питания юных спортсменов // Практическая
медицина № 07 (12) Педиатрия, 2012, С. 71-75.
28. Рычкова
Т. И., Остроухова И. П., Яцков С.
А. и др. Коррекция функциональных изменений сердечно-сосудистой
системы препаратом L-карнитина
у детей и подростков с сочетанной патологией //Лечащий врач. 2010; №8. - С.
104-106.
29. Балыкова Л.А.
Результаты и перспективы использования
средств энерготропной терапии в педиатрии на примере L-карнитина //Вопросы
практической педиатрии, №2, т. 4, 2009, С. 49–55
30. Kreider R. B. еt al. ISSN exercise & sport nutrition review: research
& recommendations //J. Intern. Society Sports Nutrition 2010; 7: рр 7–11.
31. Ивянский С.А., Балыкова Л.А., Солдатов О.М., и
др. Опыт применения Кудесана форте у детей, занимающихся спортом //Практика
педиатра: метаболическая терапия, 2009, сентябрь, С.29-36.
32. Karlic H., Lohninger A. Supplementation of
L-carnitine in athletes: does it make sense? //Nutrition 2004; 20(7-8): рр 709–15.
33. Dragan IG., Vasiliu A., Georgescu E., et al. Studies concerning chronic
and acute effects of L-carnitine in elite athletes //Physiologie 1989; 26: 111.
34. Vecchiet L., Di Lisa F., Pieralisi G. et al. Influence of L-carnitine
administration on maximal physical exercise. //Eur J Appl Physiol Occup Physiol
1990; 61: 486.
35. Huertas R., Campos Y., Diaz E. et al. Respiratory
chain enzymes in muscle of endurance athletes: effect of L-carnitine //Biochem
Biophys Res Commun 1992; 188: 102
36. Marconi C., Sassi G., Carpinelli A., Cerretelli
P. Effects of L-carnitine loading on the aerobic and anaerobic performance of
endurance athletes //Eur J Appl Physiol Occup Physiol 1985; 54: 131.
37. Muller D.M., Seim H., Kiess W., Loster H., Richter T. Effects of oral
L-carnitine supplementation on in vivo long-chain fatty acid oxidation in
healthy adults //Metabolism 2002; 51: 1389.
38.
Dragan A.M.,
Vasiliu D., Eremia N.M., et al . Studies concerning some acute biological
changes after endovenous administration of 1 g L-carnitine, in elite athletes
//Physiologie 1987; 24: 231.
39.
Arenas J., Ricoy J.R., Encinas A.R. et al. Carnitine in muscle, serum, and urine of nonprofessional athletes:
effects of physical exercise, training, and L-carnitine administration //Muscle
Nerve 1991; 14: 598.
40.
Kraemer W.J.,
Volek J.S, French D.N. et al. The effects of L-carnitine L-tartrate
supplementation on hormonal responses to resistance exercise and recovery //J
Strength Cond Res 2003; 17: 455.
41.
Jenkins R., Martin
D., Goldberg E. Lipid
peroxidation in skeletal muscle during atrophy
and acute exercise //Med Sei Sports Exerc 1983; 15(2): рр 93-94.
42.
Ostman B, Sjödin A, Michaëlsson K, et al. Coenzyme Q10 supplementation and
exercise-induced oxidative stress in humans //Nutrition. 2012 Apr;
28(4): рр 403-17.
43.
Творогова Т.М., Захарова И.Н., Коровина Н.А.,
и др. Коррекция кардиальных изменений при вегетативной дистонии у детей и подростков:
акцент на эффективность энерготропной терапии //Consilium Medicum. Педиатрия, № 3, 2009, С. 109–114.
44. Mizuno K, Tanaka M, Nozaki S, et al. Antifatigue effects оf coenzyme Q10 during physical fatigue //Nutrition. 2008
Apr;24(4): рр 293-9.
45. Wiesner RJ et al. The anaerobic
heart: succinate formation and mechanical performance //Exp Biol, 1986, 45(1): рр 55-64.